
| m |
| M |
 ��
��
| 0.56L |
| 22.4L/mol |
| 2 |
| 5 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��ͼΪʵ����ijŨ�����Լ�ƿ�ϵı�ǩ���Ը����й����ݻش���������
��ͼΪʵ����ijŨ�����Լ�ƿ�ϵı�ǩ���Ը����й����ݻش���������| Ӧ��ȡŨ�������/mL | Ӧѡ������ƿ�Ĺ��/mL |
2.1 2.1 |
250 250 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
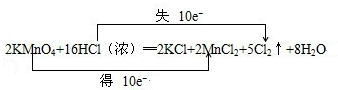
(5��)ʵ������Ѹ���Ʊ������������������·�Ӧ��
2 KMnO4+16 HCl == 2 KCl + 2 MnCl2+ 5 Cl2�� + 8 H2O
�˷�Ӧ����Ҫ���ȣ������¾Ϳ���Ѹ�ٽ��У����Ҷ������Ũ��Ҫ�ߡ�
(1)�á����ŷ�����ʾ������ת�������
2 KMnO4+16 HCl === 2 KCl + 2 MnCl2 + 5 Cl2��+ 8 H2O
(2)�÷�Ӧ�У���������__________����ԭ����_________��
(3) ������ת�Ƶ���ĿΪ6.02��1023��ʱ���ɵ����������ʵ���Ϊ mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010��2011ѧ�갲��ʡ������ʾ�����и�һ��У������ѧ�Ծ� ���ͣ������
(5��)ʵ������Ѹ���Ʊ������������������·�Ӧ��
2 KMnO4+16 HCl ="=" 2 KCl + 2 MnCl2 + 5 Cl2�� + 8 H2O
�˷�Ӧ����Ҫ���ȣ������¾Ϳ���Ѹ�ٽ��У����Ҷ������Ũ��Ҫ�ߡ�
(1)�á����ŷ�����ʾ������ת�������
2 KMnO4+16 HCl ="==" 2 KCl + 2 MnCl2 + 5 Cl2�� + 8 H2O
(2)�÷�Ӧ�У���������__________����ԭ����_________��
(3) ������ת�Ƶ���ĿΪ6.02��1023��ʱ���ɵ����������ʵ���Ϊ mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com