
【题目】探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是( )
A. 将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B. 将pH=11的氨水稀释1000倍,测得pH>8,说明NH3·H2O为弱碱
C. 加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定
D. 将红热的Pt丝伸入右图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的氧化产物为NO2

科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种浅绿色盐X(仅含四种元素,不含结晶水,M(X)<908gmol﹣1)的组成和性质,设计并完成了如下实验

取一定量的浅绿色盐X进行上述实验,充分反应后得到23.3g白色沉淀E、28.8g红色固体G和12.8g红色固体H。
已知:①浅绿色盐X在570℃、隔绝空气条件下受热分解为非氧化还原反应.
②常温下B呈液态且1个B分子含有10个电子。请回答如下问题:
(1)写出B分子的电子式 _________
(2)请写出红色固体G与足量D溶液反应的离子方程式__________
(3)X的化学式是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日照市是山东半岛蓝色经济区的重要组成部分,对海洋资源的开发受到高度重视,下列说法正确的是
A.Mg和U都属于海水中的微量元素
B.可以利用太阳能将海水蒸馏淡化生产饮用水
C.从海水中提取溴的过程不涉及氧化还原反应
D.海底多金属结核矿含有Fe、Mn、Co、B等金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向59.2g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0mol/L的NaOH溶液2.8L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6g。下列有关说法错误的是 ( )
A. Fe2O3和FeO的物质的量之比为1:6
B. 硝酸的物质的量浓度为3.0mol/L
C. 产生的NO在标准状况下的体积为4.48L
D. Fe2O3和FeO与硝酸反应后剩余0.2molHNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C7H8的某有机物,它能使酸性高锰酸钾溶液褪色,但不能与溴水反应.在一定条件下与H2完全加成,加成后其一氯代物的同分异构体有( )
A.3种
B.4种
C.5种
D.6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.3 g纯净金属钠在干燥空气中被氧化后得到3.5 g固体,由此可判断产物是( )
A. 只有Na2O B. 只有Na2O2
C. Na2O和Na2O2的混合物 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是( ) 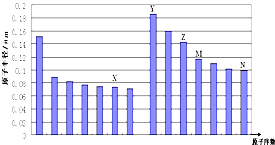
A.N、Z两种元素的离子半径相比前者较大
B.M、N两种元素的气态氢化物的稳定性相比后者较强
C.X与M两种元素组成的化合物能与碱反应,但不能与任何酸反应
D.工业上常用电解Y和N形成的化合物的熔融态制取Y的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象与对应化学(或离子)方程式都正确的是( )
A.金属钠投入水中,浮在水面熔成小球,并在水面快速移动,得到的溶液显碱性;Na+H2O═Na++OH﹣+H2↑
B.氢气在氯气中安静的燃烧,发出淡蓝色火焰,瓶口出现白雾;H2+Cl2═2HCl
C.铜与稀硝酸反应:3Cu+8H++2NO3﹣═3Cu2++2NO↑+4H2O
D.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO﹣═CaSO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关计算的分析正确的是
A. 某溶液100 mL,其中含硫酸0.03 mol,硝酸0.04 mol,若在该溶液中投入1.92 g铜粉微热,反应后放出一氧化氮气体约为0.015 mol
B. 室温时,在容积为a mL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧,则a、b的关系是a=4b+c
C. 反应KClO4+8HCl===KCl+4Cl2↑+4H2O中,每生成4 mol Cl2转移的电子数为8NA
D. 磁性氧化铁与过量稀硝酸反应的化学方程式为:Fe3O4+HNO3(稀) ![]() Fe(NO3)3+NO↑+H2O(未配平)23.2 g磁性氧化铁完全溶解于稀硝酸中,转移0.1 mol电子
Fe(NO3)3+NO↑+H2O(未配平)23.2 g磁性氧化铁完全溶解于稀硝酸中,转移0.1 mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com