
| A. | 澄清石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 硫酸氢钠碳酸氢钠溶液中加入氢氧化钡溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+2H2O | |
| C. | 向氢氧化钠溶液中通入足量CO2+2OH-+CO2?CO32-+H2O | |
| D. | 向氢氧化钡溶液中加入过量硫酸:2H++SO42-+Ba2++2OH-?BaSO4↓+2H2O |
分析 A.碳酸氢钠过量,反应生成碳酸钙沉淀和碳酸钠,反应产物中碳酸根离子有剩余;
B.反应后溶液呈中性,则碳酸氢钠与氢氧化钡按照物质的量2:1反应;
C.二氧化碳足量,反应生成碳酸氢钠;
D.氢氧化钡与硫酸反应生成硫酸钡沉淀和水.
解答 解:A.澄清石灰水与过量碳酸氢钠溶液反应,离子方程式按照氢氧化钙的化学式组成书写,正确的离子方程式为:2HCO3-+Ca2++2OH-═CO32-+CaCO3↓+2H2O,故A错误;
B.硫酸氢钠溶液中加入氢氧化钡溶液至中性,反应生成硫酸钡沉淀和水,正确的离子方程式为:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故B错误;
C.向氢氧化钠溶液中通入足量CO2,反应生成碳酸氢钠,正确的离子方程式为:OH-+CO2?HCO3-,故C错误;
D.向氢氧化钡溶液中加入过量硫酸,反应的离子方程式为:2H++SO42-+Ba2++2OH-?BaSO4↓+2H2O,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:解答题
| a | b | ||
| x | y | z |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
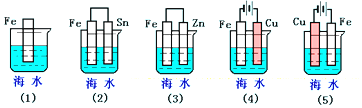
| A. | (5)(2)(1)(3)(4) | B. | (2)(5)(3)(4)(1) | C. | (5)(3)(4)(1)(2) | D. | (1)(5)(3)(4)(2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气在氯气中安静燃烧,发出苍白色火焰,瓶口出现的“雾气”是盐酸小液滴 | |
| B. | 漂白粉溶液中滴入少量盐酸,可增强其漂白效果 | |
| C. | 钠在空气中燃烧,产生黄色火焰,生成白色的Na2O的固体 | |
| D. | 铁丝在氯气中燃烧,生产棕红色的烟,氯化铁的水溶液呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠加入到紫色石蕊试液中,紫色石蕊先变红后褪色且有气泡产生 | |
| B. | 冷的浓硫酸和浓硝酸都可以用铝、铁的容器盛装 | |
| C. | 硅、氯、硫、氮、钠元素在自然界只有化合态没有游离态 | |
| D. | 浓硝酸有氧化性,稀硝酸没有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶于水能导电,属于电解质 | |
| B. | 使品红溶液褪色,有漂白性 | |
| C. | 使酸性高锰酸钾溶液褪色,有还原性 | |
| D. | 能杀菌、消毒,可按照国家标准用作食物的防腐剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验内容 | 实验目的 |
| A | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| B | 室温下,用pH试纸分别测定浓度为18mol/L和0.1mol/L H2SO4溶液的pH | 比较不同浓度H2SO4的酸性强弱 |
| C | 配制FeCl2溶液时,先将FeCl2溶于适量浓盐酸中,再用蒸馏水稀释到所需浓度,最后在试剂瓶中加入少量铜粉 | 抑制Fe2+水解,并防止Fe2+被氧化 |
| D | 向10mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/LMgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp>Ksp |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com