
| 结构简式 | 化学式 | 相对分子质量 | 沸点/℃ |
| (1)H-OH | H2O | 18 | 100 |
| (2)CH3-OH | CH4O | 32 | 64 |
| (3)CH3CH2OH | C2H6O | 46 | 78 |
| (4)CH3COOH | C2H4O2 | 60 | 118 |
| (5)CH3-O-CH3 | C2H6O | 58 | 56 |
| (6)CH3CH2CH2OH | C3H8O | 60 | 97 |
| (7)CH3CH2OCH3 | C3H8O | 60 | 11 |


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | -- | -3 | -2 | |
| A、元素X和Q形成的化合物中不可能含有共价键 |
| B、Q2-比R3-更容易失去电子 |
| C、X、Z、R的最高价氧化物的水化物之间可两两相互反应 |
| D、M(OH)2的碱性比XOH的碱性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
13 6 |
12 6 |
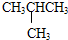
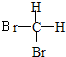 和
和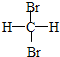 E.CH4和CH3(CH2)2CH3
E.CH4和CH3(CH2)2CH3查看答案和解析>>
科目:高中化学 来源: 题型:
 在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:
在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
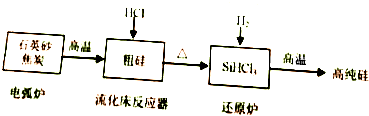 硅在地壳中的含量较高.硅及其化合物的开发由来已久,在现代生活中有广泛应用,回答下列问题:
硅在地壳中的含量较高.硅及其化合物的开发由来已久,在现代生活中有广泛应用,回答下列问题:| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ||||

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学欲探究Cl2、Br2、I2之间的变化:
某同学欲探究Cl2、Br2、I2之间的变化:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com