
| A | B | C | D |
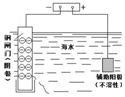
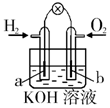
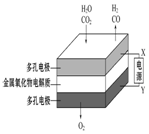
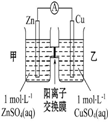
| 钢闸门容易被腐蚀 | a、b均为惰性电极,b极反应是:O+4OH--4e-=2H2O | 阴、阳两极生成的气体的物质的量之比是1:1 | 电池工作一段时间 后,乙池溶液的总质量增加 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
分析 A、金属的腐蚀与防护中如果有外接电源,此方法为外加电源的阴极保护法;
B、b极是氧气发生还原,电极反应式为:O2+4e-+2H2O=4OH-;
C、电解H2O-CO2混合气体制备H2和CO,总反应为:H2O+CO2$\frac{\underline{\;通电\;}}{\;}$H2+CO+O2,阴极产生H2、CO,阳极产生氧气,由此分析解答;
D、甲池中的Zn2+通过阳离子交换膜进入乙池,乙池中发生反应:Cu2++2e-=Cu,保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu.
解答 解:A、将钢闸门与外加电源负极相连,阴极上电解质溶液中阳离子得电子发生还原反应,此方法为外加电源的阴极保护法,可防止钢闸门腐蚀,故A错误;
B、b极是氧气发生还原,电极反应式为:O2+4e-+2H2O=4OH-,故B错误;
C、电解H2O-CO2混合气体制备H2和CO,总反应为:H2O+CO2$\frac{\underline{\;通电\;}}{\;}$H2+CO+O2,阴极产生H2、CO,阳极产生氧气,阴、阳两极生成的气体的物质的量之比是2:1,故C错误;
D、甲池中的Zn2+通过阳离子交换膜进入乙池,乙池中发生反应:Cu2++2e-=Cu,保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu,故乙池溶液总质量增大,故D正确;
故选D.
点评 本题考查电解知识,为高频考点,侧重于考查学生的综合运用能力,题目难度中等,注意基础知识的积累掌握,掌握电解池阳极发生氧化反应,阳极发生氧化反应为解答关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
 5种固体物质A、B、C、D、E由表中不同的阴阳离子组成,它们均易溶于水.
5种固体物质A、B、C、D、E由表中不同的阴阳离子组成,它们均易溶于水.| 阳离子 | Na+ Al3+Fe3+ Cu2+、Ba2+ |
| 阴离子 | OH- Cl- CO32- NO3- SO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
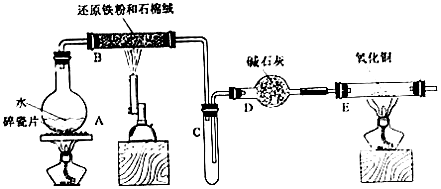
| 步骤 | 操作 | 甲组现象 | 乙组现象 | |
| 1 | 取黑色粉末加入稀盐酸 | 洛解,无气泡 | 溶解,无气泡 | |
| 2 | 取少骤1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 | |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 | |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
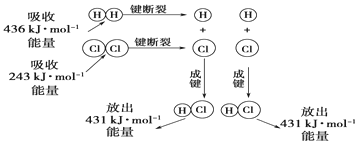
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
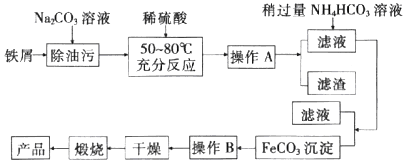
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
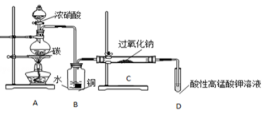 亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量.某兴趣小组进行下面实验探究,查阅资料知道:
亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量.某兴趣小组进行下面实验探究,查阅资料知道:| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al是地壳中含量最多的金属元素,但铝是使用较晚的金属 | |
| B. | Al是比较活泼的金属,在化学反应中容易失去电子,表现还原性 | |
| C. | Al箔在空气中受热可以熔化,且发生剧烈燃烧 | |
| D. | Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al并不滴落 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCOOH+OH-═HCOO-+H2O | B. | CO2+H2O?ΗCΟ3-+H+ | ||
| C. | CO32-+H2O?ΗCΟ3-+OH- | D. | HS-+H2O?S2-+H3O+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com