
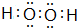 该物质能使酸性KMnO4溶液褪色,在这个反应中体现了该物质的还原性(填“氧化性”或“还原性”)
该物质能使酸性KMnO4溶液褪色,在这个反应中体现了该物质的还原性(填“氧化性”或“还原性”)分析 A、B、C、D、E为原子序数依次增大的五种短周期元素,B元素原子的最外层电子数是内层电子数的2倍,最外层最多含有8个电子,则内层电子数为2,最外层电子数为4,故B为C元素;A、E同主族,A、B、C、E都能与D在一定条件下形成两种化合物,其最简式为XY和X2Y型,则D为O元素,A为H元素,E为Na,C的原子序数介于氧和碳之间,所以C为N元素,据此解答.
解答 解:A、B、C、D、E为原子序数依次增大的五种短周期元素,B元素原子的最外层电子数是内层电子数的2倍,最外层最多含有8个电子,则内层电子数为2,最外层电子数为4,故B为C元素;A、E同主族,A、B、C、E都能与D在一定条件下形成两种化合物,其最简式为XY和X2Y型,则D为O元素,A为H元素,E为Na,C的原子序数介于氧和碳之间,所以C为N元素.
(1)由上述分析可知,A是氢元素,C是氮元素,E是钠元素,
故答案为:氢、氮、钠;
(2)H、N、O三种元素可组成离子化合物为 NH4NO3,该化合物强酸弱碱盐,铵根离子水解使其水溶液呈酸性,反应的离子方程式为:NH4++H2O=NH3•H2O+H+,
故答案为:NH4NO3;NH4++H2O=NH3•H2O+H+;
(3)最简式为AD的物质为H2O2,其电子式为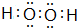 ,H2O2能使酸性KMnO4溶液褪色,在这个反应中体现了H2O2的还原性,
,H2O2能使酸性KMnO4溶液褪色,在这个反应中体现了H2O2的还原性,
故答案为: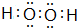 ;还原性;
;还原性;
(4)H、C、O、Na四种元素组成的无机化合物,受热分解,则该物质为NaHCO3,少量NaHCO3的水溶液与足量的Ba(OH)2溶液反应的离子方程式为:HCO3-+OH-+Ba2+=BaCO3↓+H2O,
故答案为:HCO3-+OH-+Ba2+=BaCO3↓+H2O;
(5)有反应3H2(g)+N2(g)?2NH3(g),在一定条件下8g气体H2和56g气体N2充分反应得到25.5g气体NH3,放出热量69.3kJ,则生成2mol氨气放出的热量=69.3kJ×$\frac{2mol×17g/mol}{25.5g}$=92.4kJ,则该反应的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol;
若将等量H2和N2混合气体分别充入起始温度,体积完全相同的甲、乙两个密闭容器中,维持温度恒定不变,甲容器体积不变,乙容器体积可变,由于该反应为气体体积减小的反应,所以反应达平衡后,甲中的压强小于乙,乙等效为在甲平衡的基础上增大压强,平衡正向移动,故甲、乙两个容器中N2的转化率甲小于乙,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol;小于.
点评 本题考查位置结构性质关系的综合应用,题目难度中等,正确推断各元素为解答关键,是对学生综合能力的考查,需要学生熟练掌握基础知识并迁移应用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在无色溶液中:NH4+、Fe2+、SO42-、CO32- | |
| B. | 在含有大量Ba2+ 的溶液中:NH4+、Na+、Cl-、CO32- | |
| C. | 在强碱性溶液中:Na+、Cl-、K+、SO42- | |
| D. | 在强酸性溶液中:K+、Fe2+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,NH4Cl和NH3.H2O的混合液中离子浓度可能为C(NH4+)>C(Cl-)>C(OH-)>C(H+) | |
| B. | 向0.1mol/L的CuSO4溶液中加入少量蒸馏水,溶液酸性减弱,Cu2+水解程度降低 | |
| C. | 25℃时,PH=12的NaOH溶液、PH=12的CH3COONa溶液、PH=2的硫酸,三种溶液中水的电离程度相同 | |
| D. | 25℃时,向稀氨水中通入NH3,溶液中C(OH-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
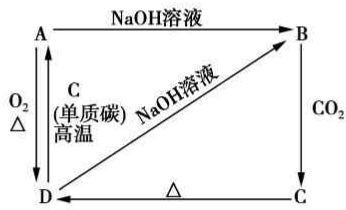 已知A是灰黑色、有金属光泽的固体单质.根据如图所示的物质之间的转化关系,回答下列有关问题. (1)写出B、C两物质的名称:B硅酸钠,C硅酸.
已知A是灰黑色、有金属光泽的固体单质.根据如图所示的物质之间的转化关系,回答下列有关问题. (1)写出B、C两物质的名称:B硅酸钠,C硅酸.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从节能角度考虑,工业选择无水氯化镁为原料冶炼镁,不选择氧化镁 | |
| B. | 若电解熔融氯化镁时有少量水,镁可能与水蒸气反应 | |
| C. | 阳极可以用不活泼金属铜、银 | |
| D. | 用湿润的KI淀粉试纸可以检阳极产生的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com