
| A、原子半径:F<O<Al |
| B、稳定性:H2O<PH3<NH3 |
| C、酸性:H2CO3<H2SO4<H3PO4 |
| D、碱性:LiOH<NaOH<Al(OH)3 |


科目:高中化学 来源: 题型:
| 选项 | 仪器 | 试剂 | 相应实验目的 |
| A | 托盘天平(带砝码)、胶头滴管、量筒、烧杯、钥匙、玻璃棒 | 食盐,蒸馏水 | 配制一定物质的量浓度的NaCl溶液 |
| B | 烧杯、分液漏斗、胶头滴管、玻璃棒 | 溴水、四氯化碳、溴化钠、碘化钠 | 除去溴化钠溶液中少量的碘化钠 |
| C | 烧杯、玻璃棒、蒸发皿 | CuSO4溶液 | CuSO4溶液的浓缩结晶 |
| D | 分液漏斗、烧瓶、锥形瓶、导管、橡皮塞 | 稀盐酸、大理石、硅酸钠溶液 | 证明非金属性:Cl>C>Si |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、简单甘油酯是纯净物,混合甘油酯是混合物 |
| B、植物油是一种良好的有机溶剂,可以用来萃取溴水中的溴单质 |
| C、天然油脂都是混合物,没有恒定的熔点、沸点 |
| D、纯天然高分子是纯净物,合成高聚物一定是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有①②③ | B、只有①②④ |
| C、只有①③④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、反应的化学方程式为2M?N |
| B、t2时V正=V逆,达到平衡 |
| C、t3时V正>V逆 |
| D、t1时浓度C(N)=2C(M) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 现象 | 结论 |
| A | 常温下将Cu片放入浓H2SO4中 | 生成刺激性气味气体 | Cu与浓H2SO4反应生成SO2 |
| B | Al2(SO4)3溶液中滴加过量氨水 | 生成白色胶状物质 | Al(OH)3不溶于氨水 |
| C | 向某溶液中加入KSCN溶液,再向溶液中加入新制氯水 | 溶液先不显红色,加入氯水后变红色 | 该溶液中含有Fe2+ |
| D | 向Na2SiO3溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min后,试管里出现凝胶 | 酸性:硅酸>盐酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
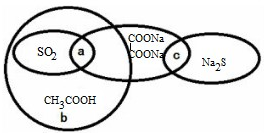
| A、SO2的水溶液能导电,所以SO2是电解质 |
| B、b可以代表含氧元素的离子化合物 |
| C、SO2、Na2C2O4均可作还原剂使酸性KMnO4溶液褪色 |
| D、CH3COOH与Na2S的反应称为酸碱中和反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com