
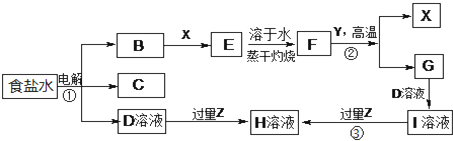
分析 (1)(2)电解饱和食盐水得到B、C、D,B是一种黄绿色气体,则B为Cl2,C在所有气体中密度最小,则C为H2,D是一种碱,则D为NaOH;X、Y是生活中应用最为广泛的金属,F是一种红棕色氧化物,常用作红色油漆和涂料,则F为Fe2O3,由转化关系可知X为Fe、E为FeCl3,反应②为铝热反应,Y为Al、G为Al2O3,与氢氧化钠反应反应生成I为NaAlO2,
(3)若Z能导致温室效应,则Z为CO2,过量的二氧化碳与偏铝酸钠溶液反应生成氢氧化铝沉淀与碳酸氢钠;
(4)若Z是我国酸雨形成的罪魁祸首,则Z为SO2,生石灰与二氧化硫、氧气反应生成硫酸钙;
(5)若Z是形成酸雨的另一种主要物质,则Z为NO2,与足量的D溶液反应时能被完全吸收,且生成两种盐(物质的量之比为1:1),发生歧化反应,有NaNO3生成,根据电子转移守恒可知有NaNO2生成,同时生成水.
解答 解:电解饱和食盐水得到B、C、D,B是一种黄绿色气体,则B为Cl2,C在所有气体中密度最小,则C为H2,D是一种碱,则D为NaOH;X、Y是生活中应用最为广泛的金属,F是一种红棕色氧化物,常用作红色油漆和涂料,则F为Fe2O3,由转化关系可知X为Fe、E为FeCl3,反应②为铝热反应,Y为Al、G为Al2O3,与氢氧化钠反应反应生成I为NaAlO2,
(1)B为Cl2,具有氧化性,反应②是Al与氧化铁反应生成氧化铝与Fe,属于置换反应,
故答案为:氧化性;置换反应;
(2)学生认为B与X反应的产物E不一定是纯净物,他认为产物中可能还有FeCl2,亚铁离子具有还原性,能使酸性高锰酸钾褪色,而氢氧化钠、KSCN与铁离子反应,影响亚铁离子检验,而硫酸不反应,故选a,
故答案为:FeCl2;a;
(3)若Z能导致温室效应,则Z为CO2,反应③是过量的二氧化碳与偏铝酸钠溶液反应生成氢氧化铝沉淀与碳酸氢钠,反应③的离子反应方程式为CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,
故答案为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-;
(4)若Z是我国酸雨形成的罪魁祸首,则Z为SO2,生石灰与二氧化硫、氧气反应生成硫酸钙,反应的化学方程式为:2SO2+2CaO+O2=2CaSO4,
故答案为:2SO2+2CaO+O2=2CaSO4;
(5)若Z是形成酸雨的另一种主要物质,则Z为NO2,与足量的D溶液反应时能被完全吸收,且生成两种盐(物质的量之比为1:1),发生歧化反应,有NaNO3生成,根据电子转移守恒可知有NaNO2生成,同时生成水,该反应的化学反应方程式为:NO2+2NaOH=NaNO2+NaNO3+H2O,
故答案为:NO2+2NaOH=NaNO2+NaNO3+H2O.
点评 本题考查无机物推断,物质的颜色、温室效应气体、形成酸雨的气体等是推断突破口,题目比较综合,需要学生熟练掌握基础知识知识,难度中等.


科目:高中化学 来源: 题型:解答题
 CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法.
CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NaCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2Na+Cl2↑ | B. | 6MgO+4Al$\frac{\underline{\;\;△\;\;}}{\;}$6Mg+2Al2O3 | ||
| C. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | D. | 2Ag2O$\frac{\underline{\;\;△\;\;}}{\;}$4Ag+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol H2O含有的原子数为NA | |
| B. | 4gH2含有氢分子数4NA | |
| C. | 常温常压下,11.2L O2中含有分子数为0.5NA | |
| D. | 1L 0.1 mol•L-1NaCl溶液中含Na+数0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠加入水中:Na+2H2O═Na++2OH-+H2↑ | |
| B. | Al2(SO4)3溶液中加入过量Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | Cl2通入水中 Cl2+H2O?2H++ClO-+Cl- | |
| D. | 向浓盐酸中加二氧化锰:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++2H2O+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  实验测定氯水的pH | |
| B. |  实验定量测定H2O2的分解速率 | |
| C. |  实验中利用NO2颜色的变化验证其中反应的热效应 | |
| D. | 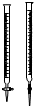 实验中(乙)管内盛放已知浓度的KMnO4溶液来测定FeSO4溶液的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Fe(OH)3 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 4.0×10-38 | 2.0×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150ml 1mol/L的NaCl溶液 | B. | 150ml 3mol/LKCl溶液 | ||
| C. | 75ml 2mol/L的NH4Cl溶液 | D. | 50ml 1mol/lCuCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +228.2 kJ•mol-1 | B. | -228.2 kJ•mol-1 | ||
| C. | +1 301.0 kJ•mol-1 | D. | +621.7 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com