
【题目】NH3是一种重要的化工原料,也是造成水体富营养化及氮氧化物污染的重要因素之一。
(1)N2和H2以物质的量之比为1∶3在不同温度和压强下发生反应:N2+3H2![]() 2NH3,测得平衡体系中NH3的物质的量分数如图1。
2NH3,测得平衡体系中NH3的物质的量分数如图1。
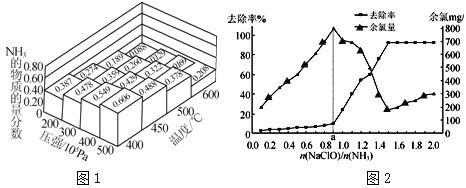
①为提高原料气的转化率,工业上采取的合理措施有 (填字母)。
a. 采用常温条件
b. 使用适当的催化剂
c. 将原料气加压
d. 将氨液化并不断移出
②图1中所示的平衡体系中NH3的物质的量分数为0.549和0.488时,该反应的平衡常数分别为K1、K2,则K1 K2。(填“>”“<”或“=”)
(2)氨氮是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的氨氮(用NH3表示)转化为氮气除去,涉及的相关反应如下:
反应①:NH3+HClO===NH2Cl+H2O
反应②:NH2Cl+HClO===NHCl2+H2O
反应③:2NHCl2+H2O===N2+HClO+3HCl
已知在水溶液中NH2Cl较稳定,NHCl2不稳定易转化为氮气。在其他条件一定的情况下,改变![]() (即NaClO溶液的投入量),溶液中次氯酸钠对氨氮去除率及余氯量 (溶液中+1价氯元素的含量)的影响如图2所示。
(即NaClO溶液的投入量),溶液中次氯酸钠对氨氮去除率及余氯量 (溶液中+1价氯元素的含量)的影响如图2所示。
①反应中氨氮去除效果最佳的n(NaClO)/n(NH3)值约为 。
②a点之前氨氮去除率较低的原因为 。
(3)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如图3。
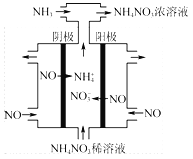
①电解过程(虚线内)发生反应的离子方程式为 。
②将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为 。
【答案】(1)①cd
②>
(2)①1.5
② NaClO用量较少,水解生成的少量HClO与NH3主要发生反应①,生成较稳定的NH2Cl。
(3)①8NO + 7H2O![]() 2H+ + 3NH4+ + 5NO3—
2H+ + 3NH4+ + 5NO3—
②1:4
【解析】
试题分析:(1)①a.采用常温条件,化学反应速率慢,故a错误;b.采用适当的催化剂,加快合成氨的速率,但不能改变转化率,故b错误;c.将原料气加压,加快了合成氨的速率,平衡正向移动,故c正确;d.将氨液化,不断移去液氨,平衡正向移动,故d正确。
故答案为: cd;
②图1中所示的平衡体系中NH3的物质的量分数为0.549的温度是400℃,0.478时的温度是450℃,该反应为放热反应,温度升高平衡向逆反应方向移动,K减小。所以,K1>K2。
故答案为:>;
(2)用次氯酸钠水解生成的次氯酸将水中的氨氮(用NH3表示)转化为氮气除去,改变![]() (即NaClO溶液的投入液),溶液中次氯酸钠去除氨氮效果与余氯图象变化中,次氯酸少氨气多,a点前发生的反应是NH3(aq)+HClO(aq)═NH2Cl(aq)+H2O(l),生成较稳定的NH2Cl;反应中氨氮去除效果最佳的从图象分析可知为去除率较高同时余氯量最少,图象中符合的比值为1.5。
(即NaClO溶液的投入液),溶液中次氯酸钠去除氨氮效果与余氯图象变化中,次氯酸少氨气多,a点前发生的反应是NH3(aq)+HClO(aq)═NH2Cl(aq)+H2O(l),生成较稳定的NH2Cl;反应中氨氮去除效果最佳的从图象分析可知为去除率较高同时余氯量最少,图象中符合的比值为1.5。
故答案为:1.5; NaClO用量较少,水解生成的少量HClO与NH3主要发生反应①,生成较稳定的NH2Cl。
(3)①工业上电解NO制备 NH4NO3,由装置图可知阳极发生氧化反应,NO被氧化生成NO3-,阴极发生还原反应,NO被还原生成NH4+,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,总反应方程式为:8NO+7H2O![]() 3NH4NO3+2HNO3。
3NH4NO3+2HNO3。
故答案为:8NO+7H2O![]() 3NH4NO3+2HNO3;
3NH4NO3+2HNO3;
②生成的硝酸和反应的NO的物质的量之比等于2:8=1:4,通入的NH3的物质的量至少应与生成的硝酸的物质的量相等,因此通入的NH3与实际参加反应的NO的物质的量之比至少为1:4。
故答案为:1:4。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】关于晶体的下列说法正确的是( )
A. 只要含有金属阳离子的晶体就一定是离子晶体
B. 离子晶体中一定含金属阳离子
C. 在共价化合物分子中各原子都形成8电子结构
D. 分子晶体的熔点不一定比金属晶体熔点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图。下列叙述正确的是( )
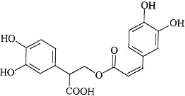
A.迷迭香酸属于芳香烃
B.1mol迷迭香酸最多能和9mol氢气发生加成反应
C.迷迭香酸可以发生水解反应、取代反应和酯化反应
 D.1mol迷迭香酸最多能和含5mol NaOH的水溶液完全反应
D.1mol迷迭香酸最多能和含5mol NaOH的水溶液完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
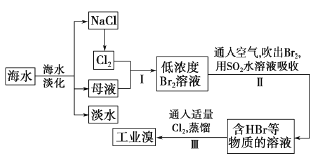
(1)请列举海水淡化的两种方法:________、_________。
(2)步骤I中己获得Br2,步骤II中又将Br2还原为Br-。其目的是_____。
(3)步骤II用SO2水溶液吸收Br2,吸收率可达95% 。有关反应的离子方程式为_________。
(4)某化学研究性学习小组为了了解从工业溴中提纯溴的方法。查阅了有关资料知:Br2的沸点为59 ℃.微溶于水,有毒并有强腐蚀性。他们参观生产过程后.画了如下装置简图:
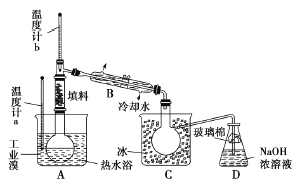
请你参与分析讨论:
①图中仪器B的名称是_______。
② 整套实验装皿中仪器连接均不能用橡胶塞和橡胶管。其原因是_______。
③ 实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?_______。
④ C中液体颜色为_______。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr,溶液,充分反应后.再进行的分离操作是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图,关闭活塞K,向A中充入1 molX、1 molY,向B中充入2 molX、2 molY,此时A、B的容积都是a L。在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g) ![]() 2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是( )
2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是( )
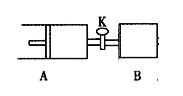
A.反应速率:v(B)>v(A)
B.B容器中X的转化率为80%
C.平衡时的压强:2p(A)=p(B)
D.平衡时Y的体积分数:A>B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com