
【题目】把铁片放入下列溶液中,铁片溶解,溶液质量增加,但没有气体放出的是
A. 稀硫酸 B. CuSO4溶液 C. Fe2(SO4)3溶液 D. AgNO3溶液
科目:高中化学 来源: 题型:
【题目】高温条件下,Al和Fe3O4反应生成Fe和Al2O3。下列说法正确的是

A. 该反应过程中的能量变化如图所示
B. 该反应条件下,Al的还原性弱于Fe
C. 1molFe3O4参与反应转移8×6.02×1023个电子
D. 实验室进行该反应时常加入KClO3作催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠的叙述中,不正确的是
A. 钠燃烧时发出黄色的火焰 B. 钠燃烧时生成氧化钠
C. 钠有很强的还原性 D. 钠原子的最外层只有一个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g) ![]() 2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率 最快的是 ( )。
2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率 最快的是 ( )。
A. v(D)=0.4 mol·(L·s)-1 B. v(A)=0.15 mol·(L·s)-1
C. v(B)=0.6 mol·(L·s)-1 D. v(C)=0.5 mol·(L·s)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的5L的密闭固定容积容器中,通入10molNH3,发生了如下反应:N2+3H2![]() 2NH3,反应进行到2min时达到平衡状态,测得容器内有2molN2,求:
2NH3,反应进行到2min时达到平衡状态,测得容器内有2molN2,求:
(1)2min内的平均速率υ(NH3)?
(2)反应前后容器中气体压强之比?
(3)NH3的分解率?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如下图,依图所示:
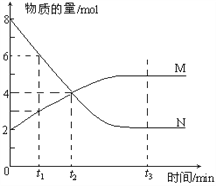
(1)该反应的化学方程式是_____________________。
(2)在图上所示的三个时刻中,_____(填t1、t2或t3)时刻处于平衡状态,此时V正____V逆(填>、<或=,);达到平衡状态后,平均反应速率v(N)﹕v(M)= _____。
(3)若反应容器的容积不变,则“压强不再改变”_______(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是_____(选填字母)。
A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰电池是日常生活中消耗量最大的电池, 其构造如图所示。放电时总反应为:Zn + 2H2O + 2MnO2==Zn(OH)2 + 2MnOOH 从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下:
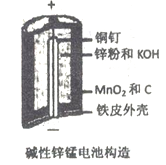
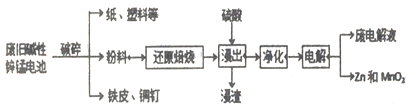
回答下列问题:
(1)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),碳作为还原剂生成CO2,则CO2的电子式为___________。
(2)“净化”是为了除去浸出液中的Fe2+,方法是:加入______(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+完全沉淀。己知浸出液中Mn2+、Zn2+的浓度约为0.1mol·L-1,根据下列数据计算,调节pH的合理范围是____至_______。
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-13 | 10-17 | 10-38 |
(离子浓度小于1×10-5 mol·L-1即为沉淀完全)
(3)“电解”时,阳极的电极反应式为______________。
本工艺中应循环利用的物质是____________(填化学式)。
(4)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2。“粉料”中的MnOOH与盐酸反应的化学方程式为___________________。
(5)某碱性锌锰电池维持电流强度0.5A (相当于毎秒通过5×10-6mol电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6 g,则电池失效时仍有________%的金属锌未参加反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015上海卷】实验室回收废水中苯酚的过程如右图所示。下列分析错误的是( )
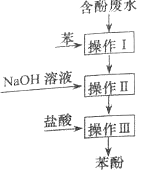
A.操作I中苯作萃取剂
B.苯酚钠在苯中的溶解度比在水中的大
C.通过操作II苯可循环使用
D.三步操作均需要分液漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【安徽省黄山市2017届高三第二次模拟考试理科综合】
硫酸锌用于制造立德粉,并用作媒染剂、收敛剂、木材防腐剂等.现欲用氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)为原料生产ZnSO4·7H2O, 工艺流程如图l:
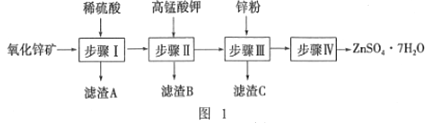
(l)步骤I的操作是_____,滤渣A的主要成分是_____。
(2)步骤I加入稀硫酸进行酸浸时,需不断通入高温水蒸气,其目的是______。
(3)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾溶液,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为_____________。
(4)步骤Ⅲ得到的滤液中,阳离子是___________。(不考虑H+)
(5)步骤IV中的烘干操作需在减压低温条件下进行,其原因是_______。
(6)取28.70 gZnSO4·7H2O加热至不同温度,剩余固体的质量变化如图2所示。650℃时所得固体的化学式为_______(填字母序号)。

a. ZnO b. Zn3O(SO4)2 c. ZnSO4 d. ZnSO4·H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com