
【题目】某化学研究性学习小组模拟工业上从浓缩的海水中提取液溴的过程,设计了如下实验装置(夹持装置略去)和操作流程。已知:![]() 的沸点为59℃,微溶于水,有毒。
的沸点为59℃,微溶于水,有毒。
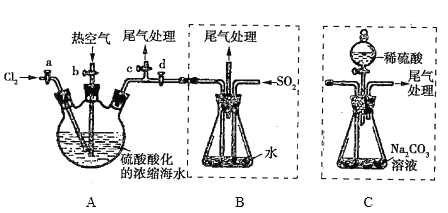
①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入![]() 至反应完全;
至反应完全;
②关闭活塞a、c,打开活塞b、d,向A中鼓入足量热空气;
③进行步骤②的同时,向B中通入足量![]() ;
;
④关闭活塞b,打开活塞a,再通过A向B中缓慢通人足量![]() ;
;
⑤将B中所得液体进行萃取、分液、蒸馏并收集液溴。
请回答下列问题:
(1)实验室中制备氯气的化学方程式为________________________________________________。
(2)步骤②中鼓入热空气的作用是_______________________________________。
(3)步骤③中发生的主要反应的离子方程式为_______________________________________。
(4)进行步骤③时,B中尾气可用_____(填序号)吸收处理。
a.水 b.浓硫酸 c. ![]() 溶液 d.饱和
溶液 d.饱和![]() 溶液
溶液
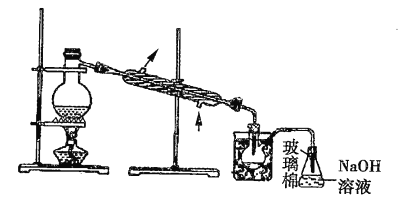
(5)步骤⑤中,用下图所示装置进行蒸馏,收集液溴,将装置图中缺少的主要仪器补画出来___________。
(6)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了![]() 等物质,该反应的化学方程式为_______________。
等物质,该反应的化学方程式为_______________。
(7)与B装置相比,采用C装置的优点为______________________________________。
【答案】![]() 使A中生成的
使A中生成的![]() 随热空气流入B中
随热空气流入B中 ![]() c 缺少的主要仪器为①②③,如下图
c 缺少的主要仪器为①②③,如下图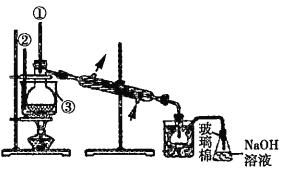
![]() 操作简单、污染小
操作简单、污染小
【解析】
实验通过反应Cl2+2Br-=2Cl-+Br2从浓缩的海水中提取溴;再利用溴单质易挥发、溴单质与二氧化硫的反应,对溴单质进行收集。
(1)实验室中制备氯气常用二氧化锰和浓盐酸反应:![]() 。
。
(2)鼓入热空气是为了将A中生成的![]() 吹入B中。
吹入B中。
(3)步骤③中发生的主要反应是Br2被二氧化硫还原为![]() 的反应,离子方程式是
的反应,离子方程式是![]() 。
。
(4)B中尾气含有![]() 、
、![]() 等,可用氢氧化钠溶液吸收。
等,可用氢氧化钠溶液吸收。
(5)蒸馏时需要温度计测定温度,为了使液体受热均匀,需采取水浴加热。
(6)![]() 与碳酸钠溶液反应生成
与碳酸钠溶液反应生成![]() ,根据氧化还原反应规律可知,该反应还生成了
,根据氧化还原反应规律可知,该反应还生成了![]() ,即
,即![]() 。
。
(7)对比B、C装置可知,采用C装置的优点为操作简单,污染小(减少二氧化硫的排放)。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的质量分数,设计如下两种实验方案。
(1)已知AlN与NaOH反应得到一种盐和一种碱性气体,化学反应方程式是____
(方案1)取一定量的样品,用图1装置测定样品中AlN的质量分数(夹持仪器已略去)。
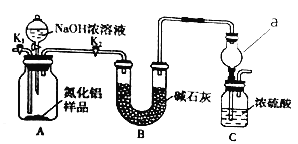
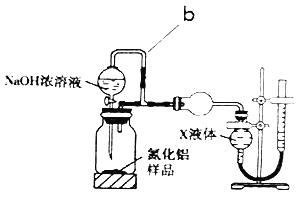
(2)图1中仪器a的名称是___
(3)完成以下实验步骤:组装好实验装置,首先检查装置气密性,再加入实验药品。关闭K1,打开K2和分液漏斗活塞,加入NaOH浓溶液至不再产生气体,打开K1,通入氮气一段时间,测定C装置在反应前后的质量变化。通入氮气的目的是____
(4)由于装置存在缺陷,导致测定结果偏高,请提出改进意见____
(方案2)用图2装置测定mg样品中AlN的质量分数(部分夹持装置己略去)。
(5)为测定生成气体的体积,量气装置中的X液体可以是___(填字母序号)。
a.CCl4 b.H2O c.饱和NH4Cl溶液 d.苯
(6)若mg样品完全反应,测得生成气体的体积为VmL(标准状况),则AlN的质量分数为___。若将b处胶管用弹簧夹夹住,其他操作均不变,则最终测定的结果___(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示(部分条件及物质未标出)。
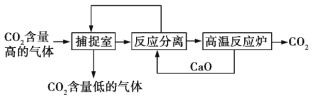
下列有关该方法的叙述中正确的是
①能耗小是该方法的一大优点
②整个过程中,有两种物质可以循环利用
③“反应分离”环节中,分离物质的基本操作是过滤、蒸发、结晶
④该方法可减少碳排放,“捕捉”到的CO2还可用来制备甲醇等产品
A.①③B.②④C.③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲中可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过如图所示实验处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成可能为( )
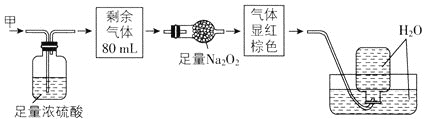
A.NO2、NH3、N2B.NH3、NO、CO2
C.NH3、NO2、CO2D.NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
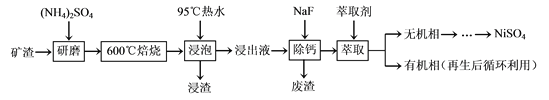
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。
(1)焙烧过程中NiFe2O4发生反应的化学方程式是___。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为___,“浸渣”的成分除Fe2O3、FeO(OH)、Fe(OH)3外还含有___、___(填化学式)。
(3)“浸泡”过程中温度低于95℃,可能导致的主要问题有___(写出一点即可)。
(4)“浸出液”中c(Ca2+)=1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-)=___mol·L-1。[已知Ksp(CaF2)=4.0×10-11]
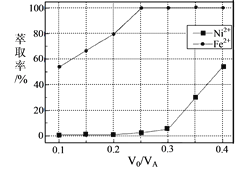
(5)本工艺中,萃取剂与溶液的体积比(![]() )对溶液中Ni2+、Fe2+的萃取率影响如图所示,
)对溶液中Ni2+、Fe2+的萃取率影响如图所示,![]() 的最佳取值是___。
的最佳取值是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)臭氧可用于烟气脱硝。O3氧化NO结合水洗,可产生HNO3和O2,该反应的化学方程式为_________________________。
(2)如图是用NH3脱除烟气中NO的原理。
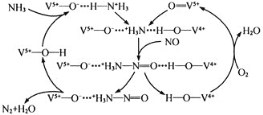
①该脱硝原理中,NO最终转化为__________(填化学式)和H2O。
②当消耗2mLNH3和0.5molO2时,除去的NO在标准状况下的体积为________L。
(3)用碱液脱硝是目前研究的课题之一。
①将NO、NO2通入石灰乳中可制备重要的工业原料Ca(NO3)2。该工艺需控制NO和NO2物质的量之比接近1:1。若n(NO2):n(NO)>1:1,则会导致_____________;若n(NO2):n(NO)<1:1,则会导致_____________。
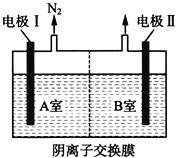
②将氢氧化钠溶液脱硝得到的NaNO2、NaNO3的混合液和NaOH溶液分别加到如图所示的电解槽中进行电解。写出A室NO2-发生的电极反应式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.1L含NA个Al3+的Al(NO3)3溶液中,NO3-物质的量浓度等于3mol/L
B.31g白磷中含有1.5NA个P-P
C.标准状况下,22.4L HF含NA个分子
D.标准状况下,1 molCl2溶于水,转移的电子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿(主要成分为![]() )为原料冶炼金属铝,主要步骤包括:①将粉碎后的铝土矿溶解在氢氧化钠溶液中;②向①的所得溶液中通入过量二氧化碳,获得氢氧化铝固体;③使氢氧化铝脱水生成氧化铝;④……
)为原料冶炼金属铝,主要步骤包括:①将粉碎后的铝土矿溶解在氢氧化钠溶液中;②向①的所得溶液中通入过量二氧化碳,获得氢氧化铝固体;③使氢氧化铝脱水生成氧化铝;④……
(1)步骤④为冶炼金属铝的过程,应选择的方法是______(填序号)。
A.以C、![]() 或
或![]() 作还原剂 B.热分解法 C.利用铝热反应原理还原 D.电解法
作还原剂 B.热分解法 C.利用铝热反应原理还原 D.电解法
(2)步骤③所涉及反应的化学方程式为_____________________________________________。
(3)步骤①所涉及反应的离子方程式为_________________________________________________。
(4)步骤②至步骤③的过程中,须经过_____操作。
(5)步骤②所得溶液中含有的大量阴离子是________________(填离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,生成的有机物只有一种的是
A.甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应
B.新戊烷和氯气发生取代反应生成一氯取代物的反应
C.苯酚与浓溴水发生取代反应生成一溴苯酚的反应
D.异戊烷和氯气发生取代反应生成一氯取代物的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com