
【题目】CO2的资源化利用能有效减少CO2的排放,充分利用碳资源。
(1)全球变暖现象很可能是大气中的温室气体(如CO2)聚集造成的。有科学家提出可以将CO2通过管道输送到海底,这样可减缓空气中CO2浓度的增加。下列有关说法正确的是______(填字母)。
A 送到海底越深的地方,CO2溶解得越多,同时CO2可能液化甚至变成干冰
B 把CO2输送到海底,会使海水酸性增强,有利于海洋生态环境
C 把CO2输送到海底,这是人类减缓空气中CO2浓度增加速率的唯一办法
D 要减缓空气中CO2浓度的增加,最有效的措施是使用新能源和植树造林
(2)已知:
①CH4(g)+2O2(g)![]() CO2(g)+2H2O(l) △H=-890 kJ· mol-1
CO2(g)+2H2O(l) △H=-890 kJ· mol-1
②2H2(g)+O2(g)![]() 2H2O(l) △H=-572 kJ· mol-1
2H2O(l) △H=-572 kJ· mol-1
则反应CO2(g)+4H2(g)![]() CH4(g)+2H2O(l) △H=______kJ· mol-1,升高温度,该反应的v(逆)__________(填“增大”或“减小”)。
CH4(g)+2H2O(l) △H=______kJ· mol-1,升高温度,该反应的v(逆)__________(填“增大”或“减小”)。
(3)CO2催化加氢合成二甲醚是CO2转化的-种方法,主要发生下列反应:
反应I:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=+41.2 kJ· mol-1
CO(g)+H2O(g) △H=+41.2 kJ· mol-1
反应II:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H=-122.5 kJ· mol-1
CH3OCH3(g)+3H2O(g) △H=-122.5 kJ· mol-1
在一体积为1 L的恒容密闭容器中,充入1 mol CO2与1 mol H2,CO2的平衡转化率和平衡时CH3OCH3的选择性随温度的变化曲线如图所示。其中:CH3OCH3的选择性=![]() ×100%。
×100%。
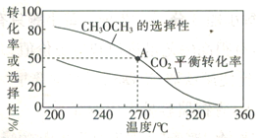
①CH3OCH3的选择性随温度的升高而降低的原因是___________,温度高于300℃时,CO2的平衡转化率随温度的升高而增大的原因是____________。
②270°C时,测得平衡时CH3OCH3的物质的量为0.1 mol,此时n(H2O)=_________mol,反应I的化学平衡常数K=___________(保留两位有效数字)。
(4)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。电解装置中分别以多晶Cu和铂为电极材料,用阴离子交换膜分隔开阴、阳极室,阴、阳极室的KHCO3溶液的浓度(约0.1 mol·L-1左右)基本保持不变。并向某极室内持续通入CO2,温度控制在10℃左右。通入CO2的电极为__________(填“阴极”或“阳极”),生成C2H4的电极反应式为_____________。
【答案】A、B、D -254 增大 生成CH3OCH3的反应反应Ⅱ的ΔH<0,为放热反应,温度越高,平衡左移,导致生成CH3OCH3的物质的量减少,虽然该反应消耗的CO2减少,但反应Ⅰ的ΔH>0,为吸热反应,温度升高平衡右移,消耗的CO2增多,总消耗的CO2的量变化不大 反应Ⅰ的ΔH>0,反应Ⅱ的ΔH<0,温度升高使CO2转化为CO的平衡转化率上升,使CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅度 0.5 0.87 阴极 ![]()
【解析】
(1)根据二氧化碳气体的性质,分析处理二氧化碳气体的可能的方法;
(2)根据盖斯定律来计算目标反应方程式的ΔH;升高温度会同时增大正逆反应速率,平衡会发生移动是因为正逆反应速率增大的幅度不同。
(3)①CH3OCH3的选择性=![]() ×100%,选择性的决定因素为生成的CH3OCH3的量和消耗的CO2的量,分析温度变化会时这两个量如何变化即选择性变化的原因;CO2的平衡转化率是由两个反应共同决定,所以要从温度变化时两个反应分别如何移动的角度去分析;
×100%,选择性的决定因素为生成的CH3OCH3的量和消耗的CO2的量,分析温度变化会时这两个量如何变化即选择性变化的原因;CO2的平衡转化率是由两个反应共同决定,所以要从温度变化时两个反应分别如何移动的角度去分析;
②已知生成的CH3OCH3的量,通过选择性的求算公式可知消耗的CO2的量,但要注意是两个反应共同消耗的CO2的量,之后根据物质之间转化时的数量关系即可求解水的物质的量;平衡常数![]() 据此求解;
据此求解;
(4)电解池中阴极得电子发生还原反应,阳极失电子发生氧化反应,通过CO2在反应中的化合价降低可知其为阴极;根据题目信息可知生成C2H4的电极为通入CO2的电极,电解池中阴离子会流向阳极,而该过程中用阴离子交换膜分隔开阴、阳极室,阴、阳极室的KHCO3溶液的浓度基本保持不变,可推测阴极有碳酸氢根生成,再结合电子守恒和元素守恒可得电极反应方程式。
(1)A海底越深的地方压强越大,CO2溶解得越多,同时CO2可能液化甚至变成干冰,故A项正确;
B.二氧化碳与水反应生成碳酸,溶液呈酸性,会使海水酸性增强,破坏海洋生态环境,故B正确;
C.减缓空气中CO2浓度的方法有多种,如合成聚二氧化碳塑料等,故C错误;
D.使用新能源,可减少二氧化碳的排放,植树造林,可降低二氧化碳的浓度,故D正确.
故答案为:A、B、D;
(2)根据盖斯定律可知目标反应方程式=②×2-①,故△H=-572×2-(-890)=-254 kJ· mol-1;升高温度正逆反应速率都增大,故答案为:-254;增大;
(3)①CH3OCH3的选择性=![]() ×100%,生成CH3OCH3的反应反应Ⅱ的ΔH<0,为放热反应,温度越高,平衡左移,导致生成CH3OCH3的物质的量减少,虽然该反应消耗的CO2减少,但反应Ⅰ的ΔH>0,为吸热反应,温度升高平衡右移,消耗的CO2增多,故CH3OCH3的选择性下降;
×100%,生成CH3OCH3的反应反应Ⅱ的ΔH<0,为放热反应,温度越高,平衡左移,导致生成CH3OCH3的物质的量减少,虽然该反应消耗的CO2减少,但反应Ⅰ的ΔH>0,为吸热反应,温度升高平衡右移,消耗的CO2增多,故CH3OCH3的选择性下降;
反应Ⅰ的ΔH>0,反应Ⅱ的ΔH<0,温度升高使CO2转化为CO的平衡转化率上升,使CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅度,故温度高于300℃时,CO2的平衡转化率随温度的升高而增大;
②270°C时,CH3OCH3的选择性为50%,CH3OCH3的物质的量为0.1 mol,根据其计算公式可知反应消耗的CO2为0.4mol,根据方程式![]() ,可知该反应中消耗的CO2为0.2mol,消耗的H2为0.6mol,生成的H2O为0.3mol,共消耗CO2为0.4mol,所以反应
,可知该反应中消耗的CO2为0.2mol,消耗的H2为0.6mol,生成的H2O为0.3mol,共消耗CO2为0.4mol,所以反应![]() 中消耗的CO2为0.4-0.2=0.2mol,消耗的H2为0.2mol生成的H2O为0.2mol,生成的CO为0.2mol,所以此时n(H2O)=0.3+0.2=0.5mol;反应I的化学平衡常数
中消耗的CO2为0.4-0.2=0.2mol,消耗的H2为0.2mol生成的H2O为0.2mol,生成的CO为0.2mol,所以此时n(H2O)=0.3+0.2=0.5mol;反应I的化学平衡常数![]() ,容器的体积为1L,此时容器中CO2的浓度为
,容器的体积为1L,此时容器中CO2的浓度为![]() ,CO的浓度为
,CO的浓度为![]() ,H2O的浓度为
,H2O的浓度为![]() ,所以平衡常数
,所以平衡常数![]() ,故答案为:0.5;0.87;
,故答案为:0.5;0.87;
(4)该过程中CO2经反应后生成C2H4,C元素化合价降低,被还原,还原反应发生在阴极,故通入CO2的电极为阴极;阴离子会流向阳极,而该过程中用阴离子交换膜分隔开阴、阳极室,阴、阳极室的KHCO3溶液的浓度基本保持不变,可推测阴极有碳酸氢根生成,故电极反应方程式为![]() ,故答案为:阴极;
,故答案为:阴极;![]() 。
。


科目:高中化学 来源: 题型:
【题目】我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置进行脱硫,将硫化氢气体转化成硫沉淀。已知甲、乙池中发生的反应为(右图):下列说法正确的是
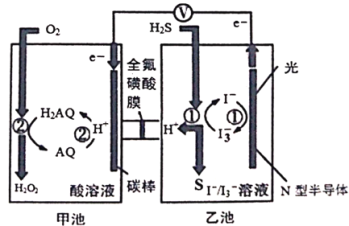
A. 甲池中得到H2O2的反应,H2O2既是氧化产物也是还原产物
B. 电路中每转移0.2mol电子,甲池溶液质量变化3.4g,乙池溶液质量保持不变
C. 光照时乙池电极上发生的反应为:H2S+I3-=3I-+S+2H+
D. 甲池中炭棒上发生的电极反应为:AQ+2H+-2e-=H2AQ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁与稀硝酸的反应为:Mg+HNO3(稀)——Mg(NO3)2+NO↑+H2O
(1)配平上述化学方程式并用“双线桥法”表示该反应中电子转移的方向和数目_____________。
(2)该反应中,还原产物是_________,HNO3表现了___________(选填“还原性”、“氧化性”、“酸性”、“碱性”)。还原剂与氧化剂的的物质的量之比为____________。
(3)若反应过程中转移的电子为0.6 mol,则被还原的硝酸物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向恒容的密闭容器中充入一定量的NO2(g),发生反应2NO2(g)![]() N2O4(g)△H<0。下列选项中不能作为判断反应是否达到平衡状态的因素的是
N2O4(g)△H<0。下列选项中不能作为判断反应是否达到平衡状态的因素的是
A.混合气体的平均相对分子质量B.NO2(g)的百分含量
C.容器内压强D.NO2和N2O4的反应速率之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活密切相关。请按要求,回答下列问题:
(1)春秋末期工艺官书《考工记》中记载有“涑帛”的方法,即利用含有碳酸钠的水溶液来洗涤丝帛。请写出碳酸钠水溶液中通入CO2气体的化学方程式____,将54.8g Na2CO3和NaHCO3 的混合物分成等量的两份,一份溶于水后加入足量盐酸,收集到气体V L,另一份直接加热至恒重,生成气体2.24L(所有气体体积均在标准状况下测定),则原固体混合物中Na2CO3的物质的量:n(Na2CO3)=____,气体V=____。
(2)“84”消毒液在生活中使用广泛,其有效成分是次氯酸钠。可在常温下将氯气通入NaOH溶液制得,该反应的离子方程式为____,若有2mol氯气参与该反应,则此时转移的电子数为____NA。
(3)小苏打可用于治疗胃酸过多,其反应的离子方程式为____。
(4)长石是地表岩石最重要的造岩矿物。某种长石的化学组成KAlSi3O8则将其改写成氧化物的组合形式为____。
(5)葡萄糖(分子式C6H12O6)是人体活细胞的能量来源。已知1mol等于1000mmol,某体检单的一些指标如图,则每升该样品中含葡萄糖的质量为____g(请保留两位小数)。
9 | 白球比 | 1.6 | |
10 | 乳酸脱氢酶 | 161 | U/L |
11 | 磷酸肌酸激酶 | 56 | U/L |
12 | 甘油三酯 | 0.52 | mmol/L |
13 | 总胆固醇 | 4.27 | mmol/L |
14 | 高密度脂蛋白胆固醇 | 1.57 | mmol/L |
15 | 低密度脂蛋白胆固醇 | 1.40 | mmol/L |
16 | 葡萄糖 | 4.94 | mmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)常温下,测得0.1 mol·L-1Na2A溶液的pH=8,则Na2A溶液中各离子的浓度大小关系为______________。
(2)将0.2000 mol·L-1HB溶液与0.1000 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液中c(Na+)<c(B-)。
①混合溶液中c(B-)________(填“>”“<”或“=”)c(HB)。
②混合溶液中c(HB)+c(B-)________(填“>”“<”或“=”)2c(Na+)。
(3)已知在常温下常见弱酸的电离平衡常数Ka如表所示:
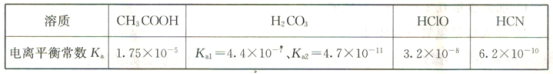
①同物质的量浓度的CH3COONa、NaClO、NaCN溶液中阴离子(不含OH-)浓度大小关系为____________。
②同pH的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是________(填字母)。
a HCN b HClO c H2CO3 d CH3COOH
③常温下物质的量浓度相同的醋酸和醋酸钠混合液的pOH=8,则c(CH3COO-)-c(CH3COOH)=____________(用数值列出计算式即可) mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题。
I.五种元素的原子电子层结构如下:A:1s22s22p63s23p63d54s2、B:1s22s22p63s2、C:1s22s22p6、D:1s22s22p63s23p2、E:[Ar]4s1。
请回答:(填元素符号)
(1)________元素是稀有气体。含未成对电子数最多的元素是________。
(2)A元素原子的核外电子共有________种运动状态,能量最高的能级是________(填能级符号)。
(3)D元素原子的价层电子排布图是________。
(4)________元素的电负性最大,________元素原子的第一电离能最大,________元素最可能生成具有催化性质的氧化物。
II.Q、R、X、Y、Z五种元素的原子序数依次递增,除Z以外,其余的均为短周期主族元素。已知:
①Q原子2p能级上有一个空轨道;
②R原子核外L层电子数为奇数;
③X原子2p轨道上只有一对自旋相反的电子;
④Y原子价电子(外围电子)排布msnmpn;
⑤Z原子M层所有轨道全部充满,N层无成对电子,只有1个未成对电子。请回答下列问题:
(5)Z2+的核外电子排布式是________,X元素基态原子的核外电子排布图是____________。
(6)Q与Y分别形成的最简单气态氢化物中,稳定性更强的是________(填化学式)。
(7)Q、R、X、Y三种元素的第一电离能数值由大到小的顺序为________(用元素符号作答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向仅含Fe2+、I-、Br-的溶液中通入适量氯气,溶液中这三种离子的物质的量随消耗氯气物质的量的变化如下图所示。下列说法中正确的是( )
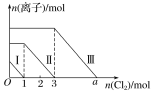
A.线段Ⅲ代表Fe2+的变化情况
B.线段Ⅰ代表Br-的变化情况
C.a值等于6
D.原混合溶液中n(FeBr2)=4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y是合成香料、医药、农药及染料的重要中间体,可由X在一定条件下合成:

下列说法不正确的是( )
A.Y中有三种官能团
B.由X制取Y的过程中可得到乙醇
C.一定条件下,Y能发生加聚反应和缩聚反应
D.等物质的量的X、Y分别与NaOH 溶液反应,最多消耗NaOH的物质的量之比为3∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com