


| A.BaSO4的溶解度、Ksp均不变 | B.BaSO4的溶解度增大,Ksp不变 | C.BaSO4的溶解度不变,Ksp增大 | D.BaSO4的溶解度、Ksp均增大 |
科目:高中化学 来源:不详 题型:单选题


A.电子从3S能级跃迁到3P能级形成的光谱是发射光谱 | B.白磷(P4)分子是正四面体结构,故分子中的键角为1090281 | C.NO2-中心原子采取sp2杂化,分子空间构型为“V”形 | D.原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | | A-B | A=B | A≡B |
| CO | 键能(kJ/mol) | 357.7 | 798.9 | 1071.9 |
| 键能差值kJ/mol) | 441.2 273 | |||
| N2 | 键能(kJ/mol) | 154.8 | 418.4 | 941.7 |
| 键能差值kJ/mol) | 263.6 523.3 | |||
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2SO3>H2SO4? |
| B.HNO3>HNO2? |
| C.H3PO3>HPO3? |
| D.HClO>HClO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
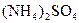 中检出组成为
中检出组成为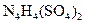 的物质,经测定,该物质易溶于水,在水中以
的物质,经测定,该物质易溶于水,在水中以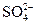 和
和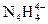 两种离子形式存在,植物的根系极易吸收
两种离子形式存在,植物的根系极易吸收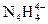 ,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。| A.同种单质 | B.同位素 | C.同分异构体 | D.同素异形体 |
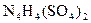 ______________(填“能”或“不能”)和草木灰混合施用:
______________(填“能”或“不能”)和草木灰混合施用: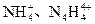 的空间构型均为四面体,
的空间构型均为四面体,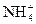 的结构式为
的结构式为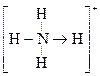 (
(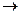 表示共用电子对由N原子单方面提供),白磷(P4)的结构式为
表示共用电子对由N原子单方面提供),白磷(P4)的结构式为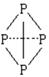
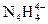 的结构式____________________________________;
的结构式____________________________________;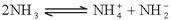 。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的
。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的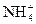 生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_____________________________________________;
生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_____________________________________________;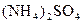 和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。
和NH3·H2O的水溶液称为“缓冲溶液”,在此溶液中加入少量的强碱或强酸时,溶液的pH几乎不变,这可由下列离子方程式来说明。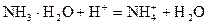
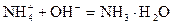
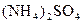 和
和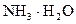 的大量存在,加少量酸或碱时,溶液中
的大量存在,加少量酸或碱时,溶液中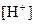 与
与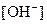 基本保持不变;
基本保持不变;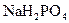 和
和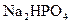 的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:
的溶液,也具有缓冲作用,写出此溶液中加入少量强酸或强碱时发生的离子反应方程式:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.羟基(-OH)和氢氧根(OH-) | B.甲烷(CH4)和铵根(NH4+) |
| C.氨气(NH3)和水(H2O) | D.双氧水(H2O2)氯化氢(HCl) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com