
| A. | C2H2 | B. | C2H6O | C. | C4H6 | D. | C2H4 |
分析 根据物质的组成判断耗氧量,物质的量相同的烃CxHy的耗氧量取决于x+$\frac{y}{4}$,物质的量相同的含烃氧衍生物CxHyOz耗氧量取决于x+$\frac{y}{4}$-$\frac{z}{2}$,据此判断物质的量相同各物质的耗氧量.
解答 解:A、C2H2,其x+$\frac{y}{4}$=2+$\frac{1}{2}$=2.5,即1molC2H2消耗2.5mol氧气;
B、C2H6O,其于x+$\frac{y}{4}$-$\frac{z}{2}$=2+$\frac{6}{4}$-$\frac{1}{2}$=4,即1molC2H6O消耗4mol氧气;
C、C4H6,其x+$\frac{y}{4}$=4+$\frac{6}{4}$=6.5,即1molC4H6消耗6.5mol氧气;
D、C2H4,其于x+$\frac{y}{4}$=2+1=3,即1molC2H4消耗3mol氧气;
故耗氧量最大的是C4H6.
故选:C.
点评 考查有机物耗氧量规律,难度较小,掌握有机物耗氧量规律,注意知识的归纳总结.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
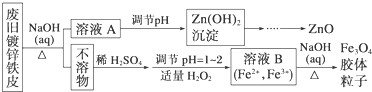
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
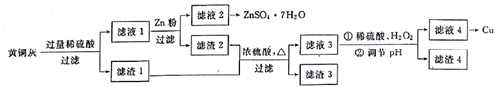
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
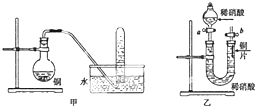 如图是甲、乙两位同学探究铜与稀硝酸.反应还原产物的实验装置图,请回答下列问题:
如图是甲、乙两位同学探究铜与稀硝酸.反应还原产物的实验装置图,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | 用Ag作电极电解硝酸银溶液:4Ag++2H2O $\frac{\underline{\;通电\;}}{\;}$ 4Ag+O2↑+4H+ | |
| D. | 向AgCl悬浊液中加入饱和NaI溶液反应的离子方程式:AgCl+I-═AgI+Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| W | X | Y | Z | |
| 结构或 性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应 呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小,它的最高价氧化物为两性氧化物 | 最高正价与最低负价之和为零 |
 ,它对应的水化物与Y的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
,它对应的水化物与Y的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.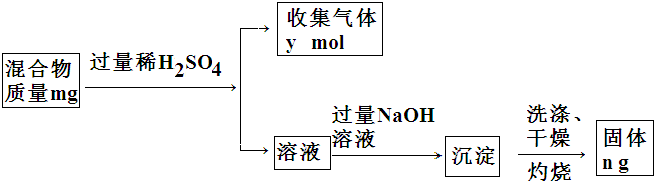
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙醇中含有水(生石灰,蒸馏) | |
| B. | 甲烷中含有乙烯(溴水,洗气) | |
| C. | 溴苯中溶有溴(苯,分液) | |
| D. | 乙烷中含有乙烯(酸性高锰酸钾溶液,洗气) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com