
 ,X属于共价化合物.
,X属于共价化合物. .
. 分析 5种短周期元素A、B、C、D、E,①A与D同族、C与E同族、B与C同周期,且原子序数A<B<C<D<E,可知B、C处于第二周期,D、E处于第三周期;②气态W由A和B组成,且W分子中,A与B的原子个数比为4:1;液态X由A和C组成,且X分子中A与C的原子个数比为1:1,可推知A为H元素、B为C元素、C为O元素,W为CH4、X为H2O2,Y由C和D组成,属离子化合物,且测得Y固体中C与D的原子个数比为1:1,则D为Na,Y为Na2O2;③Z由D和E组成,属离子化合物,且其阳离子比阴离子少1个电子层,阳离子数与阴离子数之比为2:1,则E为S,Z为Na2S,以此解答该题.
解答 解:5种短周期元素A、B、C、D、E,①A与D同族、C与E同族、B与C同周期,且原子序数A<B<C<D<E,可知B、C处于第二周期,D、E处于第三周期;②气态W由A和B组成,且W分子中,A与B的原子个数比为4:1;液态X由A和C组成,且X分子中A与C的原子个数比为1:1,可推知A为H元素、B为C元素、C为O元素,W为CH4、X为H2O2,Y由C和D组成,属离子化合物,且测得Y固体中C与D的原子个数比为1:1,则D为Na,Y为Na2O2;③Z由D和E组成,属离子化合物,且其阳离子比阴离子少1个电子层,阳离子数与阴离子数之比为2:1,则E为S,Z为Na2S,
(1)由以上分析可知W为CH4,为共价化合物,故答案为:CH4;共价;
(2)X为H2O2,电子式是 ,X属于共价化合物,故答案为:
,X属于共价化合物,故答案为: ;共价;
;共价;
(3)Na2O2与CO2反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,固体质量增加为与二氧化碳等物质的量的CO的质量,故1molNa2O2反应固体质量增重为1mol×28g/mol=28g,
故答案为:增大;28g;
(4)Z为Na2S,属于离子化合物,用电子式表示其形成过程为 ,
,
故答案为: .
.
点评 本题考查元素化合物推断,为高频考点,涉及电子式、化学键、化学计算等,侧重考查学生的分析、计算能力的,需要学生熟练掌握常见元素化合物性质与结构,难度中等.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 2:1:2:3 | B. | 2:1:4:6 | C. | 2:1:4:3 | D. | 1:1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核内有10个中子的氧原子:${\;}_{6}^{18}$O | |
| B. | 氯原子的结构示意图: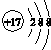 | |
| C. | Fe3+的最外层电子排布式为3s23p63d5 | |
| D. | 基态铜原子的外围电子排布图: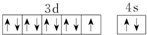 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C三种固体物质的溶解度曲线如图所示.
A、B、C三种固体物质的溶解度曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两个电极均为铁片,M是阴极,电解质溶液是0.4%的NaOH溶液 | |
| B. | 两个电极均为石墨,M是阳极,电解质溶液是0.4%的H2SO4溶液 | |
| C. | M是铁片,作阴极,N是石墨,电解质溶液是0.4%的Ba(NO3)2溶液 | |
| D. | M是铁片,作阴极,N是石墨,电解质溶液是0.4%的HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com