
分析 A遇水剧烈反应,产生能使湿润红色石蕊试纸变蓝的气体C和黄色沉淀D,则C应为NH3,D在空气中最终变为蓝色固体,该蓝色固体加热生成黑色固体E,则D应为CuOH,E为CuO,二元化合物A由X、Y两元素组成,根据元素守恒可知,A应由Cu、N两种元素组成,则气体Y单质应为N2,X单质为Cu,它具有良好的电学和光学性能,20.6gA隔绝空气加热至300℃完全分解,产生19.2gCu和1.12LN2(标准状况),则A中铜元素和氮元素的物质的量之比为$\frac{19.2}{64}:\frac{1.12}{22.4}$=3:1,所以A为Cu3N,据此答题.
解答 解:A遇水剧烈反应,产生能使湿润红色石蕊试纸变蓝的气体C和黄色沉淀D,则C应为NH3,D在空气中最终变为蓝色固体,该蓝色固体加热生成黑色固体E,则D应为CuOH,E为CuO,二元化合物A由X、Y两元素组成,根据元素守恒可知,A应由Cu、N两种元素组成,则气体Y单质应为N2,X单质为Cu,它具有良好的电学和光学性能,20.6gA隔绝空气加热至300℃完全分解,产生19.2gCu和1.12LN2(标准状况),则A中铜元素和氮元素的物质的量之比为$\frac{19.2}{64}:\frac{1.12}{22.4}$=3:1,所以A为Cu3N,
(1)Y元素为氮元素,在周期表中放入位置第2周期第ⅤA族,镁与氮气反应产物的化学式是Mg3N2,
故答案为:第2周期第ⅤA族;Mg3N2;
(2)Cu3N在300℃下隔绝空气加热分解的化学方程式为2Cu3N$\frac{\underline{\;300℃\;}}{\;}$6Cu+N2,
故答案为:2Cu3N$\frac{\underline{\;300℃\;}}{\;}$6Cu+N2;
(3)Cu3N与足量盐酸反应,产生白色沉淀为氯化亚铜,反应的化学方程式为Cu3N+4HCl=3CuCl↓+NH4Cl,
故答案为:Cu3N+4HCl=3CuCl↓+NH4Cl;
(4)黄色固体CuOH变为蓝色固体Cu(OH)2的原因是因为氢氧化亚铜被空气中的氧气所氧化,反应的方程式为4CuOH+O2+2H2O=4Cu(OH)2,
故答案为:4CuOH+O2+2H2O=4Cu(OH)2 ;
(5)CuO和NH3加热反应,有红色固体铜或氧化亚铜生成,其化学方程式为3CuO+2NH3$\frac{\underline{\;△\;}}{\;}$3Cu+N2+3H2O或6CuO+2NH3$\frac{\underline{\;△\;}}{\;}$3Cu2O+N2+3H2O,检验红色固体成分 的方法是取少量固体mg加入稀硫酸后过滤、洗涤、干燥到恒重,称量固体质量为ng,根据m与n的关系确定其组成,
故答案为:3CuO+2NH3$\frac{\underline{\;△\;}}{\;}$3Cu+N2+3H2O或6CuO+2NH3$\frac{\underline{\;△\;}}{\;}$3Cu2O+N2+3H2O;取少量固体mg加入稀硫酸后过滤、洗涤、干燥到恒重,称量固体质量为ng,根据m与n的关系确定其组成.
点评 本题考查了无机推断,题目难度较大,涉及的知识点较多,注意掌握无机推断的方法与技巧,明确有关物质的颜色变化是解题的关键,试题充分考查了学生的分析、理解能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
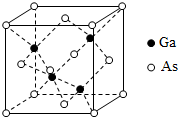 砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,测得氯化铵溶液pH<7,证明一水合氨是碱:NH4++2H2O═NH3•H2O+H3O+ | |
| B. | 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 用碳酸氢钠溶液检验水杨酸中的羧基: +2HCO3-→ +2HCO3-→ +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-═2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的化学平衡常数表达式是K=[c4(C)•c2(D)]/[c3(A)•c2(B)] | |
| B. | 0~5min内A的反应速率为0.24mol•L-1•min-1 | |
| C. | 此时B的平衡转化率是40% | |
| D. | 增大该体系的压强,平衡向右移动,化学平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属原子间以共价键结合的物质都是共价化合物 | |
| B. | 金属元素和非金属元素不可能形成共价化合物 | |
| C. | 凡是能电离出离子的化合物都是离子化合物 | |
| D. | 离子化合物中可能有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com