
【题目】现有A、B、C、D、E、F六种装置,如图所示。(胶塞、导管可自由选用)。已知:实验室可用下列反应制取氧气2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
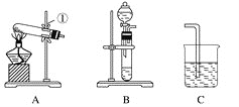
(1)写出仪器名称:①________,②________。
(2)实验室制取并收集氧气时,应选择____________和________相连接。
(3)做木炭还原氧化铜并检验生成气体的实验时,应选择________和________相连接,检验生成气体时使用的试剂是________,检验气体时观察到的实验现象是_________________。
(4)制取氢气并做还原氧化铜的实验时,应选择______和________装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是_______________________________。
【答案】铁架台 酒精灯 A E A C 澄清石灰水 C中溶液变浑浊 B D 防止生成的铜再和氧气反应
【解析】
(1)根据仪器的图形、构造判断仪器的名称;
(2)实验室可用加热氯酸钾固体制备氧气,根据氧气密度大于空气分析;
(3)做木炭还原氧化铜并检验生成气体的实验,可在大试管中加热条件下进行,用澄清石灰水检验;
(4)用稀硫酸和锌反应制备氢气,在大试管中加热条件下进行还原实验,实验结束时应先停止加热,待试管冷却后,再停止通氢气,防止铜被氧化。
(1)由仪器的图形、构造判断①为铁架台,②为酒精灯;
(2)实验室可用加热氯酸钾固体制备氧气,氧气密度比空气大,可用向上排空法收集,则选用A、E装置;
(3)做木炭还原氧化铜并检验生成气体的实验,可在大试管中加热条件下进行,氧化产物是二氧化碳,因此可用澄清石灰水检验,所以用A、C装置,检验气体时观察到的实验现象是C中澄清石灰水变浑浊;
(4)用稀硫酸和锌反应制备氢气,在大试管中加热条件下进行还原实验,可用B、D装置,在加热的条件下铜易被氧化,所以实验结束时应先停止加热,待试管冷却后,再停止通氢气,防止生成的铜再和氧气反应。


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是 ( )
A. 澄清石灰水与过量苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓ +CO32-+2H2O
B. 用惰性电极电解NaHS溶液:HS-+ H2O![]() S↓+H2↑+OH-
S↓+H2↑+OH-
C. 向摩尔盐溶液中加入过量的Ba(OH)2溶液:2NH4+ + Fe2+ + 2SO42- + 2Ba2+ + 4OH- = 2BaSO4↓+ Fe(OH)2↓+ 2NH3·H2O
D. 明矾溶液中加入Ba(OH)2溶液至生成的沉淀质量最多:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、钴及其相关化合物用途非常广泛。回答下列问题:
(1)基态Co原子价电子轨道排布式为________,第四电离能I4(Co)<I4(Fe),其原因是_______;Co与Ca同周期且最外层电子数相同,单质钴的熔沸点均比钙大,其原因是_______.
(2)单质硫与熟石灰加热产物之一为CaS3,S32-的几何形状是_______,中心原子杂化方式是_______,与其互为等电子体的分子是_______ (举1例)。
(3)K和Na位于同主族,K2S的熔点为840℃,Na2S的熔点为950℃,前者熔点较低的原因是_______ 。
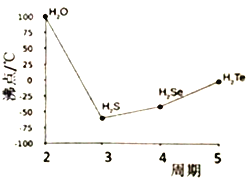
(4)S与O、Se、Te位于同一主族,它们的氢化物的沸点如右图所示,沸点按图像所示变为的原因是_______ 。
(5)钴的一种化合物晶胞结构如下图所示。

①已知A点的原子坐标参数为为(0,0,0),B点为(![]() ,0,
,0,![]() ),则C点的原子坐标参数为_____。
),则C点的原子坐标参数为_____。
②已知晶胞参数为a=0.5485nm,则该晶体的密度为_____g/cm3(列出计算表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅晶体是立体的网状结构,其结构如图所示。
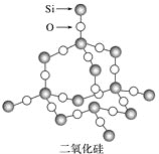
下列关于二氧化硅晶体网状结构的叙述正确的是
A. 存在四面体结构单元,O处于中心,Si处于4个顶角
B. 在最小的环上,有3个Si原子和3个O原子
C. 在最小的环上,Si和O的原子个数之比为1∶2
D. 在最小的环上,有6个Si原子和6个O原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pOH= -lgc(OH-)。298 K时,向20.00 mL0.10mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH和pOH与加入盐酸体积关系如图所示。下列说法正确的是
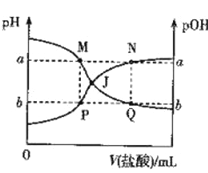
A. 曲线PJN表示溶液中PH的变化
B. M点水的电离程度比Q点大
C. M、P两点的数值之和a + b = 14
D. pH与pOH交叉点J对应的V(盐酸)=20.00 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A在一定条件下可以转化为有机物E,其转化关系如下图。已如烃A在标准状况下的密度为1.16g/L,加热时B与新制氢氧化铜产生砖红色沉淀。E为有浓郁香味、不易溶于水的油状液体。
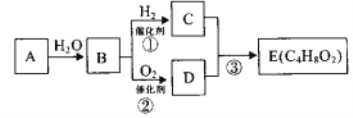
请回答:
(1)B中官能团的结构简式为_____,C中官能团的名称为______,E的核磁共振氢谱图中有_____组峰。
(2)写出化学方程式:
②____________;③__________。
(3)下列说法正确的是______ (填标号)。
a.C物质与金属制反应比水与金属钠反应更剧烈
b.有机物C、D、E可用饱和Na2CO3溶液鉴别
c.实验室制各E时,加入浓盐酸做催化剂
d.B能被酸性KMnO4溶液氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲、乙两种物质:

(1)乙中含有的官能团的名称为__________________(不包括苯环)。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
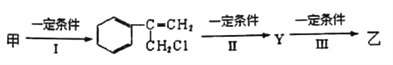
反应I的化学其中反应I的反应类型是____________________,反应II的条件是________,反应III的化学方程式为_________________(不需注明反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为N2H4+O2===N2+2H2O。下列说法正确的是
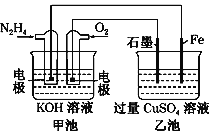
A. 乙池中Fe电极上发生氧化反应
B. 乙池中石墨电极上发生的反应可写为4OH--4e-===2H2O+O2↑
C. 甲池溶液pH增大,乙池溶液pH减小
D. 甲池中每消耗0.1 mol N2H4乙池电极上则会析出6.4 g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌焙砂是锌精矿经焙烧后所得的产物,以锌焙砂为原料制取金属锌的流程如图所示。
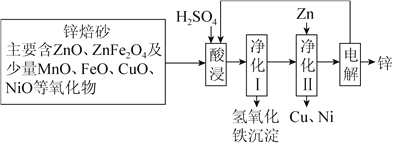
已知:①当溶液中Zn2+浓度较大时,Zn2+优先于H+放电。
②碱性条件下Mn(Ⅱ)可以被氧气氧化生成Mn(Ⅵ)。
请回答下列问题:
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为_____________________________。
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式:___________。
②25 ℃时,pH=3的滤液(滤去氢氧化铁沉淀)中,c(Fe3+)=________mol·L-1(已知25 ℃时,Ksp[Fe(OH)3]=4.0×10-38)。
(3)电解硫酸锌溶液时阳极上有气体析出,写出阳极的电极反应式_____________________________;
电解时不断补充电解液的目的是_________________________。
(4)电解时,阳极附近发生化学反应生成HMnO4,使得溶液变为紫红色,生成的HMnO4,又将Mn2+氧化生成MnO2,一部分二氧化锰沉于槽底形成阳极泥,另一部分附于阳极表面形成保护膜。写出HMnO4将Mn2+氧化生成MnO2的化学方程式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com