
【题目】以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是

A. X、Y两端都必须用铁作电极
B. 不可以用NaOH溶液作为电解液
C. 阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH-
D. X端为电解池的阳极
【答案】C
【解析】试题分析:左边装置是原电池,通入氢气的电极I是负极、通入氧气的电极II是正极,负极反应式为H2-2e-+CO32-═CO2+H2O,正极反应式为O2+4e-+2CO2=2CO32-,右边装置是电解池,X是阴极、Y是阳极,阴极反应式为2H2O+2e-=H2↑+2OH-、阳极反应式为Fe-2e-+2OH-=Fe(OH)2↓。A.X、Y两端,阳极X必须是铁电极,Y电极不需要一定用铁作电极,可以用石墨电极,故A错误;B.电解过程是阴极上氢离子放电得到溶液中的氢氧根离子交换亚铁离子生成氢氧化亚铁,所以可以用NaOH溶液作为电解液,故B错误;C.阴极发生的反应是溶液中的氢离子得到电子生成氢气,碱溶液中电极反应:2H2O+2e-=H2↑+2OH-,故C正确;D.X连接原电池负极,所以是电解池阴极,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应 X(g)+Y(g)![]() 2Z(g)+W(g)达到平衡时,VA=1.2aL,则下列说法正确的是( )
2Z(g)+W(g)达到平衡时,VA=1.2aL,则下列说法正确的是( )

A. 反应开始时,B容器中化学反应速率快
B. A容器中X的转化率为40%,且比B容器中X的转化率小
C. 打开K一段时间达平衡时,A的体积为1.6aL(连通管中气体体积不计)
D. 打开K达新平衡后,升高B容器温度,A容器体积一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.C燃烧的热化学方程式为:C(s)+1/2O2(g)=CO(g) △H = 110.5kJ·mol-1
B.由H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1可知,若将含1molCH3COOH的稀溶液与含1molNaOH的稀溶液混合,放出的热量小于57.3kJ
C.碳酸氢钠水解的离子方程式:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D.500℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放出热量19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的氨水和氢氧化钠溶液分别加水稀释,平衡pH随溶液体积变化的曲线如图所示,据图判断正确的是
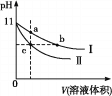
A. Ⅱ为氨水稀释时的pH变化曲线 B. a、b、c三点溶液的导电性:c>b=a
C. a、b、c三点溶液中水的电离程度:c=b>a D. a、b、c三点溶液的KW:c=b<a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中正确的是
A. 提取溶解在水中的少量碘:加入酒精振荡、静置分层后,取出有机层再分离
B. 下图所示装置都适宜于HCl气体尾气吸收
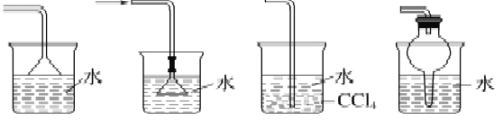
C. 酸碱滴定实验中,用待测溶液润洗锥形瓶以减小实验误差;在用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体。
D. 除去酸性MgCl2溶液中少量的FeCl3:加入足量的Mg(OH)2 并过滤;除去NH4Cl溶液中的FeCl3,可向溶液中加入氨水调节pH .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制备氯气并验证氯气性质的装置(其中夹持装置已省略)。
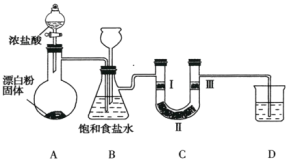
已知:装置A是氯气的发生装置,反应的化学方程式为![]() 。
。
据此回答下列问题:
(1)装置B中饱和食盐水的作用是_________。
(2)装置B也是安全瓶,目的是监测实验进行时装置C中是否发生堵塞,请写出装置C中发生堵塞时装置B中的实验现象:__________________。
(3)装置C的作用是验证氯气是否具有漂白性,则装置C中I、Ⅱ、Ⅲ处依次应放入的物质是___________(填字母)。
序号 | I | Ⅱ | Ⅲ |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)装置D的作用是_____________________________。
(5)如果将20mL、10mol·L-1的浓盐酸与足量次氯酸钙充分反应,实际能收集到的氯气在标准状况下的体积将__________。
A.≥2.24 L B.>2.24 L C.≤2.24 L D.<2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物。
(1)写出溴乙烷与NaOH水溶液共热的反应方程式:_______________,某同学取少量溴乙烷与NaOH水溶液反应后的混合溶液,向其中滴加AgNO3溶液,加热,产生少量沉淀。该同学由此得出溴乙烷与NaOH水溶液反应,生成了溴化钠,你认为是否合理,原因:____________________。
(2)写出溴乙烷与NaOH乙醇溶液共热的反应方程式:________,反应中生成的气体可以用如图所示装置检验,现象是______,水的作用是 ______。

(3)乙烯使溴水褪色的化学方程式: __________________________,X是比乙烯相对分子质量大14的乙烯的同系物,工业上用X生产塑料的化学方程式为:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,则下列说法不正确的是
A. 标准状况下,18gH2O所含电子数为10NA
B. 22.4L CO2与17 g NH3所含分子数相等
C. 0.9g铝与足量的盐酸反应,失去的电子数为0.1NA
D. 常温下,1L 0.1mol/L NaCl溶液中含Na+ 数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶于水时会发生电离产生自由移动的离子,电导率变化一定程度上可以反映溶液中自由移动的离子浓度变化。溶液中自由移动的离子浓度越大,电导率就越大。如图是向20mL0.01mol/LBa(OH)2溶液中滴入了2滴酚酞溶液,然后向Ba(OH)2溶液中匀速滴加0.2mol/LH2SO4溶液,获得电导率随时间变化的曲线图。
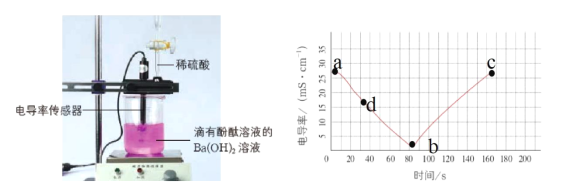
(1)0-80s观察到的实验现象是_____。
(2)写出该实验中的离子方程式_____。
(3)截至b点,加入0.2molL-1H2SO4溶液的体积为_____mL,解释b点的电导率不等于零和bc段电导率又增加的原因____。
(4)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是(_____)(多选题)
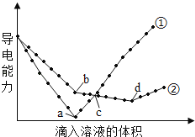
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.a、d两点对应的溶液均显中性
D.c点,两溶液中含有相同量的OH-
E.H+导电能力比Na+强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com