
 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )| A. | 该温度下HB的电离平衡常数约等于1.11×10-5 | |
| B. | 当lg$\frac{V}{{V}_{0}}$=3时,若两溶液同时升高温度,则$\frac{c({B}^{-})}{c({A}^{-})}$减小 | |
| C. | 相同条件下NaA溶液的pH大于NaB溶液的pH | |
| D. | 溶液中水的电离程度:a=c>b |
分析 0.1mol/L的HA溶液的pH=1,说明HA完全电离,所以HA为强酸,0.1mol/L的HB溶液的pH>2,说明HB在溶液中部分电离,所以HB是弱酸;
A.a点时,存在平衡:HB?H++B-,稀释100倍后,HB溶液的pH=4,溶液中c(A-)≈c(H+)=10-4mol/L,结合Ka=$\frac{c({H}^{+})c({B}^{-})}{c(HB)}$计算;
B.升高温度促进弱酸的电离,酸根离子浓度增大,强酸的酸根离子浓度不变;
C.强酸强碱盐不水解,强碱弱酸盐水解显碱性;
D.酸抑制水的电离,酸电离出的氢离子浓度越大,对水的抑制程度越大.
解答 解:0.1mol/L的HA溶液的pH=1,说明HA完全电离,所以HA为强酸,0.1mol/L的HB溶液的pH>2,说明HB在溶液中部分电离,所以HB是弱酸;
A.a点时,存在平衡:HB?H++B-,稀释100倍后,HB溶液的pH=4,溶液中c(A-)≈c(H+)=10-4mol/L,则Ka=$\frac{c({H}^{+})c({B}^{-})}{c(HB)}$=$\frac{1{0}^{-4}×1{0}^{-4}}{0.001-1{0}^{-4}}$=1.11×10-5,故A正确;
B.升高温度促进弱酸的电离,所以HB中B-浓度增大,强酸的酸根离子浓度不变,所以A-的浓度不变,因此$\frac{c({B}^{-})}{c({A}^{-})}$增大,故B错误;
C.HA为强酸,NaA是强酸强碱盐不水解,溶液显中性,NaB为强碱弱酸盐,水解显碱性,所以相同条件下NaA溶液的pH小于NaB溶液的pH,故C错误;
D.酸抑制水的电离,酸电离出的氢离子浓度越大,对水的抑制程度越大,氢离子浓度:a=c>b,所以溶液中水的电离程度:a=c<b,故D错误;
故选A.
点评 本题考查弱电解质电离与影响因素、电离平衡常数、pH有关计算等,关键是根据pH的变化判断强弱电解质,注意理解电离平衡常数计算过程中的估算问题,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
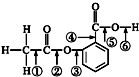 阿司匹林的结构简式如图,①②③④⑤⑥分别标出了其分子中不同的键.请判断阿司匹林与乙醇发生反应时,断键的位置是( )
阿司匹林的结构简式如图,①②③④⑤⑥分别标出了其分子中不同的键.请判断阿司匹林与乙醇发生反应时,断键的位置是( )| A. | ⑤ | B. | ⑥ | C. | ③ | D. | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ② | C. | ①③ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1mol NH4BF4(氟硼酸铵)中含有2NA个配位键.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com