
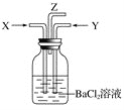
【题目】把二氧化硫通入硝酸铁溶液中,溶液由黄色变为浅绿色,但立即又变为黄色,此时若滴入氯化钡溶液,则会产生白色沉淀。在上述一系列变化过程中,最终被还原的是( )
A.SO2B.NO3-C.Fe3+D.Fe2+
【答案】B
【解析】
Fe3+具有氧化性,能将SO2氧化成硫酸,自身被还原为Fe2+,故溶液变为浅绿色;随着溶液中H+浓度的增大,NO3-逐渐显现出其强氧化性,再将Fe2+氧化为Fe3+,而NO3-中氮元素从+5价变为+2价,故最终氮元素被还原。
由滴入BaCl2溶液,则会产生白色沉淀,则可知SO2通入Fe(NO3)3溶液中发生的氧化反应为SO2→SO42-,溶液由黄色变为浅绿色,但立即又变为黄色,+3价的Fe3+变为+2价的Fe2+,后又被氧化为+3价的Fe3+,S、Fe元素得化合价在变化中升高,则可知还原反应为H++NO3-→NO↑+H2O,即最终被还原的为NO3-,故合理选项是B。


科目:高中化学 来源: 题型:
【题目】2010年5月1日上海世博会隆重开幕,受到全世界人们的关注。世博会的环保概念是人们关心的话题,环保材料更为世人瞩目,其中聚碳酸酯是用得较多的材料。聚碳酸酯的结构简式如图所示,下列说法正确的是( )
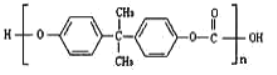
A.它是由一种单体聚合而成的B.它是通过加聚反应得到的产物
C.它是一种纯净物D.它不耐强碱,可发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如下表:下列说法正确的是( )
2Z(g),各组分在不同时刻的浓度如下表:下列说法正确的是( )
物质 | X | Y | Z |
初始浓度(mol/L) | 0.1 | 0.2 | 0 |
2min末浓度(mol/L) | 0.08 | a | b |
平衡浓度(mol/L) | 0.05 | 0.05 | 0.1 |
A.平衡时,X的转化率为20%
B.t℃时,2min末Y与Z的物质的量浓度:a=0.06mol/L,b=0.4mol/L
C.增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动
D.前2min内,用Y的变化量表示的平均反应速率v(Y)=0.03mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝苯地平是抗心绞痛药,也可用于降血压,其合成路线如下。
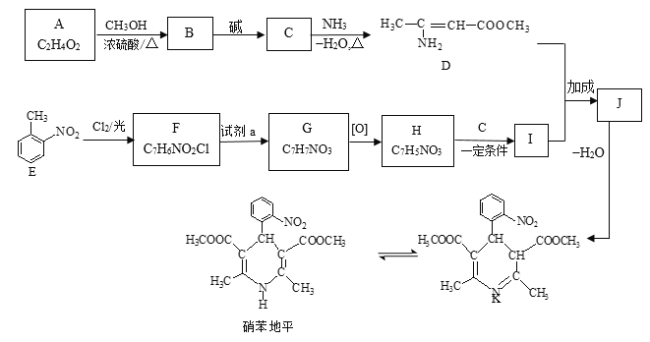
已知: Ⅰ. RCOOR1+![]()
![]()
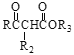 +R1OH
+R1OH
Ⅱ. R1CHO+![]()
![]()
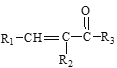
Ⅲ.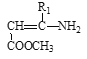 +
+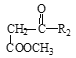
![]()

![]()
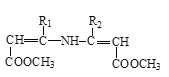
请回答下列问题:
(1)A属于羧酸,写出A的电离方程式________。
(2)A→B的反应类型为________。
(3)D的官能团名称为________。
(4)写出B→C的方程式________。
(5)F→G所需的试剂a是________。
(6)聚合物L的单体是E的同分异构体,其单体结构同时满足以下条件,写出L的结构简式:________。
a. 具有两性 b. 苯环上的一氯代物共有两种
(7)写出结构简式:I________ 、J________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.NH3·H2O在水中的电离:NH3·H2O=NH4++OH
B.苯酚钠溶液中通入少量CO2:2![]() +CO2+H2O=2
+CO2+H2O=2![]() +CO32-
+CO32-
C.FeCl3溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+
D.碳酸氢钙溶液中加少量澄清石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上用氯化铵焙烧菱锰矿粉制备高纯度碳酸锰的工艺流程如下:
已知:①菱锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子c(Mn+) ═ 0.1 mol L -1形成M(OH) n沉淀的pH范围如下:
金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ | Ca2+ | Mn2+ |
开始沉淀的pH | 1.5 | 3.8 | 6.3 | 9.6 | 10.6 | 8.8 |
沉淀完全的pH | 2.8 | 5.2 | 8.3 | 11.6 | 12.6 | 10.8 |

回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为_____________________________。
(2)浸出液“净化除杂”过程如下:①加入MnO2将Fe2+氧化为Fe3+;②调节溶液pH,将Al3+、Fe3+变为沉淀除去,调节pH范围为__________③加入NH4F将___________离子(填离子符号)沉淀除去。
(3)碳化结晶时,反应的离子方程式为_____________________________________。
(4)碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是________________。流程中能循环利用的物质除了氯化铵之外还有____________。
(5)测定碳酸锰产品的纯度。
称取0.5000 g碳酸锰产品于锥形瓶中,加25.00 mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至100 mL,滴加2~3滴指示剂,然后用浓度为0.2000 mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3- +Fe2+ ═Mn2+ +Fe3++2PO43-)。重复操作3次,记录数据如下表:
滴定次数 | 0.2000 mol·L-1的硫酸亚铁铵标准溶液读数(mL) | |
滴定前 | 滴定后 | |
1 | 0.10 | 20.20 |
2 | 1.32 | 21.32 |
3 | 1.05 | 20.95 |
则产品的纯度=__________,若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度_______(填“偏高”“ 偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。根据题意回答下列问题:

(1)若A、B、C的焰色反应均为黄色,C为厨房中的用品,D的过度排放会造成温室效应。
①A的化学式______________、B的俗名____________;
②反应II的离子方程式是__________________________________。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应II的离子方程式是_____________________________;
②反应Ⅲ的离子方程式是_____________________________;
③检验B中阳离子最好的方法是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度恒定的条件下,在2 L容积不变的密闭容器中,发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)。开始充入4 mol的SO2和2 mol的O2,10 s后达到平衡状态,此时c(SO3)=0.5 mol·L-1,下列说法不正确的是 ( )
2SO3(g)。开始充入4 mol的SO2和2 mol的O2,10 s后达到平衡状态,此时c(SO3)=0.5 mol·L-1,下列说法不正确的是 ( )
A.v(SO2)∶v(O2)=2∶1B.10 s内,v(SO3)=0.05 mol·L-1·s-1
C.SO2的平衡转化率为25%D.平衡时容器内的压强是反应前的5/6倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】松萝酸常作为牙膏和化妆品的添加剂,可由化合物X经过两步反应制得,下列有关说法不正确的是

A.X、Y均能与NaHCO3溶液反应产生气体
B.化合物X和Y与FeCl3溶液均可发生显色反应
C.1mol化合物X与浓溴水反应时最多能与2molBr2反应
D.lmol化合物Y最多能与8molH2反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com