
超音速飞机在平流层飞行时,尾气中的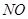 会破坏臭氧层。科学家正在研究利用催化技术将尾气中的
会破坏臭氧层。科学家正在研究利用催化技术将尾气中的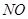 和
和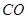 转变成
转变成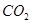 和
和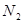 ,化学方程式:2NO+2CO
,化学方程式:2NO+2CO 2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度(mol·L-1)如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
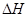 0(填写“>”、“<”、“=”)。
0(填写“>”、“<”、“=”)。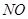 和
和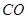 转变成
转变成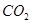 和
和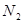 的反应速率的是 。
的反应速率的是 。| 实验编号 | T/℃ | NO初始浓度 | CO初始浓度 | 催化剂比表面积/m2·g-1 |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | | | | 124 |
| Ⅲ | 350 | | | 124 |
(1)< (2分) (2) 1.88×10-4mol/(L·s) (2分)(3)A、B、D (3分)
(4)①在下表中填入剩余的实验条件数据(5分)实验编号 T/℃ NO初始浓度 CO初始浓度 催化剂比表面积/m2·g-1 Ⅰ 280 1.20×10-3 5.80×10-3 82 Ⅱ 280 1.20×10-3 5.80×10-3 124 Ⅲ 350 1.20×10-3 5.80×10-3 124
②在下表中画出上表中的Ⅰ、Ⅱ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线是实验编号。(起点,趋势,终点,开始浓度数值各1分,)(4分)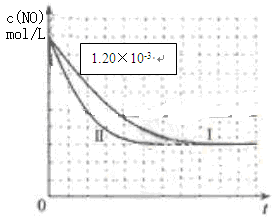
解析试题分析:
(1)E反应物>E生成物,所以该反应为放热反应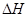 < 0
< 0
(2)v(N2)=△c (N2)/t=1.88×10-4mol/(L·s)
(3)C项降低反应体系温度使化学反应速率降低,A、B、D 项使化学反应速率升高。
(4)①对比实验一般只有一个变量故答案如下:实验编号 T/℃ NO初始浓度 CO初始浓度 催化剂比表面积/m2·g-1 Ⅰ 280 1.20×10-3 5.80×10-3 82 Ⅱ 280 1.20×10-3 5.80×10-3 124 Ⅲ 350 1.20×10-3 5.80×10-3 124
②略
考点:


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:填空题
氮气与氢气反应生成氨气的平衡常数见下表:
| | N2+3H2 2NH3 2NH3 | |||
| 温度 | 25℃ | 200℃ | 400℃ | 600℃ |
| 平衡常数K | 5×108 | 650 | 0.507 | 0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料。工业合成氨的反应如下:N2(g) +3H2(g)  2NH3(g) △H=一92. 4 KJ·mol-1
2NH3(g) △H=一92. 4 KJ·mol-1
(1)2NH3(g)  N2(g) +3H2(g)在恒容密闭容器中达到平衡的标志有
N2(g) +3H2(g)在恒容密闭容器中达到平衡的标志有
①单位时间内生成3n mol H2:同时生成2n mol NH3②用NH3、N2、H2表示反应速率比为2∶1∶3 ③混合气体的密度不再改变 ④混合气体压强不再改变 ⑤混合气体平均相对分子质量不再改变
| A.①③④ | B.①②④⑤ | C.①④⑤ | D.②③④ |
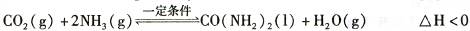
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2) /mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
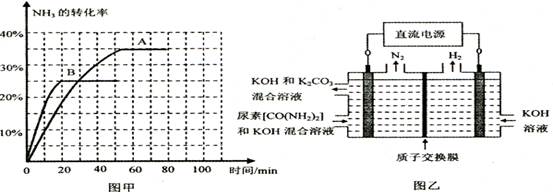
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为减少污染,常将煤转化为清洁气体燃料,可将焦炭与水蒸气反应转化为氢气和一氧化碳:C(s)+ H2O(g)  H2(g)+ CO(g)
H2(g)+ CO(g) 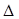 H>0。现在容积固定为2L密闭容器中,加入2mol C(s)和2mol H2O(g),在T℃下充分反应,半分钟后达到平衡,测得H2为0.75mol。
H>0。现在容积固定为2L密闭容器中,加入2mol C(s)和2mol H2O(g),在T℃下充分反应,半分钟后达到平衡,测得H2为0.75mol。
(1)用H2O(g)表示反应开始到达到平衡的平均速率 ;
(2)计算T℃下该反应的平衡常数K= ;若温度升高,则反应平衡常数将 (填“增大”“减小”或“不变”)。
(3)上述条件下该反应达到平衡状态,下列说法正确的是
| A.缩小容器体积,平衡向左移动 | B.加入催化剂,CO的产率增大 |
| C.增加碳的量,H2O(g)的转化率增大 | D.降低温度,H2O(g)的转化率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有可逆反应:mA(g)+nB(g)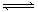 pC(g)+ qD(g);根据下图示回答:
pC(g)+ qD(g);根据下图示回答: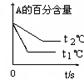
(1)左图中温度t1℃ t2℃(填“高于”或“低于”)
(2)该反应的正反应为 反应(填“吸热”或“放热”)
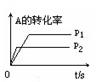
(3)右图中压强 p1 p2(填“>”、“<”、“=”)
(4)反应式中(m +n) (p +q)(填“>”、“<”、“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一定条件下,反应室(容积恒定为2L)中有反应:A(g) +2B(g) C(g)
C(g)
(1)能说明上述反应达到平衡状态的是 (选填字母)。
A.反应中A与B的物质的量浓度之比为1︰2
B.混合气体总物质的量不再变化
C.混合气体的密度不随时间的变化而变化
D.2υ正(A)= υ逆(B)
(2)该反应平衡常数K的表达式:K= 。
(3)1molA(g)与2molB(g)在催化剂作用下在反应室反应生成C(g),A的平衡转化率与温度、压强的关系如下图所示,则:
①P1 P2 , 正反应的△H 0(填“<”、“>”或“=”)。
②下列措施中一定能使c(C)/c(A)增大的是 (选填编号)。
A.升高温度 B.恒温恒容再充入A
C.恒温恒容再充入B D.恒温恒容再充入1 mol C
(4)100℃时将1mol A和2molB通入反应室,保持温度不变,10min末C(g) 的浓度为0.05mol/L ,则10min末B转化率= ,此时υ正 υ逆
(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应: 2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) -Q(Q>0)
CH3CH2OH(g)+3H2O(g) -Q(Q>0)
在密闭容器中,按H2与CO2的物质的量之比为3:1进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如下图所示。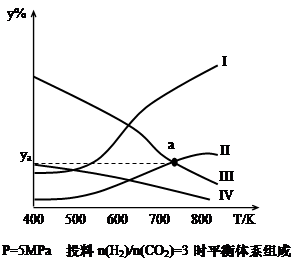
完成下列填空:
(1)表示CH3CH2OH体积分数曲线的是_______(选填序号)
(2)在一定温度下反应达到平衡的标志是_______(选填编号)
a.平衡常数K不再增大
b.CO2的转化率不再增大
c.混合气体的平均相对分子质量不再改变
d.反应物不再转化为生成物
(3)其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是_______(选填编号);达到平衡后,能提高H2转化率的操作是_______(选填编号)
a.降低温度 b.充入更多的H2
c.移去乙醇 d.增大容器体积
(4)图中曲线II和III的交点a对应的体积分数ya=_______%
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)(1)在固定容积为2L的密闭容器中通入NO和CO各2mol发生反应: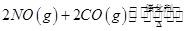
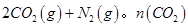 随温度(T)、压强(P)和时间(t)的变化曲线如图所示。请回答下列问题:
随温度(T)、压强(P)和时间(t)的变化曲线如图所示。请回答下列问题: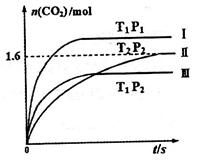
①曲线I、II、III对应反应从开始到平衡时用CO2表示的平均反应速率分别为 、
、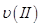 、
、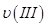 ,则三者大小关系为______________。
,则三者大小关系为______________。
②该反应△H__________0(填“>”、“=”或“<”);曲线II对应平衡常数K=_________;曲线II对应的反应达平衡后,再通入2molNO和2molCO并保持温度不变,则再达平衡时NO的转化率将_______(填“增大”、“减小”或“不变”)。
(2)①25℃时,将0.2mol/L的HCOOH溶液与0.2mol/L的NaOH 溶液等体积混合,充分反应后测得溶液pH为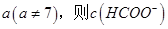 ________
________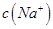 (填“>”、“=”或“<”),则HCOO-的水解平衡常数(Kh)可近似表示为______________(用含a的代数式表示)。
(填“>”、“=”或“<”),则HCOO-的水解平衡常数(Kh)可近似表示为______________(用含a的代数式表示)。
②一定温度下,0.2mol/Lr HCOOH溶液加水稀释过程中,下列各项中随着加水量的增加而减小的是____________(填写字母序号)。
a.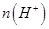 b.
b.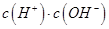 c.
c.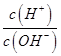 d.
d.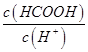
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com