
CuSO4∙5H2O是铜的重要化合物,有着广泛的应用。CuSO4∙5H2O的实验室制法如下:
Ⅰ.实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程(Fe3+在pH=5时已完全沉淀)

回答下列问题:
⑴用98%的浓硫酸配制溶解所用的4.5 mol∙L-1的稀硫酸,只需 种玻璃仪器
⑵步骤②目的是将溶液Ⅰ中的Fe2+充分转化成Fe3+,实验操作是
发生反应的离子方程式:
⑶如何证明Fe2+已经充分转化?
⑷步骤④之后的实验操作是 ,所需仪器是铁架台(带铁圈)、
及抽滤装置。
Ⅱ.实验室用铜粉制备的CuSO4∙5H2O流程图如下:
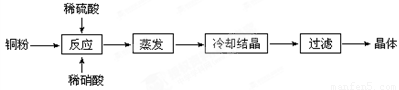
根据题意完成下列填空:
⑴理论上,为了制得纯净的CuSO4·5H2O晶体,需要消耗稀硫酸、稀硝酸溶质物质的量之比为 ,
发生反应的离子方程式为 。
⑵实际制得的胆矾晶体中还是含有一些杂质,通常采用 法提纯。
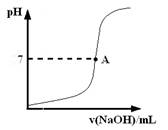
⑶实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定。滴定过程中若用酚酞作指示剂,终点现象是
。
请在图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点)。

⑷上述使用的标准氢氧化钠溶液已经通过基准物质的标定。下列物质中通常可用来标定碱液的基准物质是 。
A.醋酸 B.草酸 C.苯甲酸 D.苯酚
Ⅰ.⑴5 ⑵加入适量H2O2 2 Fe2++H2O2+2 H+=2 Fe3++2H2O
⑶取溶液Ⅱ少许,加入(H+)KMnO4溶液,若溶液不褪色,则Fe2+已充分转化
⑷蒸发浓缩,冷却结晶 蒸发皿、玻璃棒、酒精灯。
Ⅱ.⑴3∶2,3Cu+8 H++2NO3-=3Cu2++2NO↑+4H2O。 ⑵重结晶
⑶加入最后一滴标准液,溶液变浅红色并在30s内不褪色。
⑷BC。
【解析】Ⅰ.(1)需要的玻璃仪器水量筒、烧杯、玻璃棒、容量瓶、胶头滴管共计5种。
(2)要氧化亚铁离子,且不能引入新的杂质,应该选择双氧水,方程式为2 Fe2++H2O2+2 H+=2 Fe3++2H2O。
(3)因为亚铁离子具有还原性,能使酸性高锰酸钾溶液褪色,据此可以检验,即取溶液Ⅱ少许,加入(H+)KMnO4溶液,若溶液不褪色,则Fe2+已充分转化。
Ⅱ.(1)发生反应的离子方程式为3Cu+8 H++2NO3-=3Cu2++2NO↑+4H2O,所以消耗稀硫酸、稀硝酸溶质物质的量之比(8-2)÷2︰2=3︰2。
(2)要进一步提纯硫酸铜晶体,则需要重结晶。
(3)因为碱能使酚酞试液显红色,所以终点现象是加入最后一滴标准液,溶液变浅红色并在30s内不褪色。临近终点是pH会发生突变,图像为(见答案)。
(4)醋酸是弱酸,苯酚的酸性更弱,所以答案选BC。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源:2013-2014学年安徽省濉溪县高三第四次月考化学试卷(解析版) 题型:选择题
下列由相关实验现象所推出的结论正确的是
A.C12、SO2均能使滴有酚酞的NaOH溶液褪色,说明二者均有漂白性
B.“水滴石穿”是因为溶解了CO2的雨水与CaCO3作用生成Ca(HCO3)2
C.CuSO4∙5H2O遇浓硫酸颜色变白,说明浓硫酸具有脱水性
D.溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42-
查看答案和解析>>
科目:高中化学 来源:2013-2014学年安徽省濉溪县高三第三次月考化学试卷(解析版) 题型:填空题
某学校化学兴趣小组为探究金属回收物的综合利用,专门设计实验用含有铝、铁、铜的合金制取纯净的AlCl3溶液和胆矾晶体(CuSO4∙5H2O),其实验方案如下:
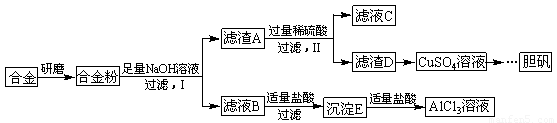
请回答下列问题:
(1)将合金研磨成合金粉的目的是 。
(2)分别写出步骤Ⅰ、Ⅱ中发生反应的化学方程式:
Ⅰ: ;
Ⅱ: 。
(3)在滤液B转化为沉淀E的过程中盐酸的用量不易控制,可将加入适量的盐酸改为通入一种气体,该气体的电子式为 ,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式: 。
(4)该小组成员从资料中获知H2O2是一种绿色氧化剂,在滤渣D中加入稀硫酸和H2O2可制得CuSO4,该反应的总化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇区高三上学期期末(一模)考试化学试卷(解析版) 题型:选择题
测定CuSO4∙nH2O的结晶水含量,方法是:称量样品→ 在坩埚中加热→ 冷却→ 称量无水盐。若用相同方法测试下列晶体中的结晶水含量,可行的是
A.Cu(NO3)2∙nH2O B.MgCl2∙nH2O C.MgSO4∙nH2O D.FeSO4∙nH2O
查看答案和解析>>
科目:高中化学 来源:2012-2013学年北京市通州区高三年级上学期期末摸底考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.2 mol/L KCl溶液与1 mol/L K2SO4溶液混合后,c(K+)为2 mol/L
B.120 g NaCl溶液中溶有20 g NaCl,该温度下NaCl的溶解度为20g
C.22.4 L HCl气体溶于水制成1 L溶液,该溶液的物质的量浓度为1 mo1/L
D.把5 g胆矾(CuSO4∙5H2O)溶于45 g水中,所得溶液溶质的质量分数为10%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com