
【题目】氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如图: 
(1)由FeCl36H2O晶体制备无水FeCl3应采取的措施是: .
(2)六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液制得FeCl36H2O晶体的操作步骤是:加入少量盐酸、、、过滤、洗涤、干燥.
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)=molL﹣1 . (常温下Ksp[Fe(OH)3]=2.6×10﹣39)
(4)FeCl3的质量分数通常可用碘量法测定:称取2.300g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用0.1000molL﹣1Na2S2O3溶液滴定用去12.50mL.
已知:I2+2S2O32﹣=2I﹣+S4O62﹣
①写出加入稍过量的KI溶液反应的离子方程式.
②求样品中氯化铁的质量分数(写出计算过程)
【答案】
(1)在通HCl气体的氛围下加热
(2)加热浓缩;冷却结晶
(3)2.6×10﹣9
(4)解:①KI溶液与FeCl3发生氧化还原反应生成碘单质和二价铁,离子方程式为:2Fe3++2I﹣=2Fe2++I2;
②12.50mLNa2S2O3溶液含有Na2S2O3物质的量为12.50×10﹣3 L×0.1000molL﹣1=1.25×10﹣3mol,则:
根据关系式:
2Fe3+ | ~ | I2 | ~ | 2S2O32﹣ |
2 | 2 | |||
n(Fe3+) | 1.25×10﹣3mol×10 |
所以 n(Fe3+)=1.25×10﹣3mol×10=1.25×10﹣2mol,
所以2.300g无水氯化铁样品中氯化铁的质量为1.25×10﹣2mol×162.5g/mol=2.03125g
所以2.300g无水氯化铁样品中氯化铁的质量分数为 ![]() ×100%=88.32%;
×100%=88.32%;
故答案为:88.32%.
【解析】解:(1)因为Fe3+易水解生成挥发性的HCl,所以由FeCl36H2O晶体得到无水FeCl3 , 应在氯化氢气流中加热FeCl36H2O晶体,得到无水FeCl3 ,
所以答案是:在通HCl气体的氛围下加热;(2)由表中数据可知,温度越高氯化铁的溶解度越高,由溶液获得晶体需加加热浓缩,再冷却结晶;所以答案是:加热浓缩;冷却结晶;(3)当溶液pH为4时,溶液中c(OH﹣)=10﹣10mol/L,Ksp[Fe(OH)3]=c(Fe3+)c3(OH﹣)=2.6×10﹣39 , 所以溶液中c(Fe3+)= ![]() =2.6×10﹣9 molL﹣1 , 所以答案是:2.6×10﹣9;
=2.6×10﹣9 molL﹣1 , 所以答案是:2.6×10﹣9;


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作或事故处理正确的是
A.金属Na着火,立即用水扑灭
B.实验结束后,用嘴吹灭酒精灯
C.皮肤上不慎沾上浓NaOH溶液,立即用盐酸冲洗
D.稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”要求从技术上、经济上设计可行的化学反应,使其尽可能减少对环境的负作用。下列化学反应中,不符合绿色化学概念的是
A. 用氨水吸收硫酸厂的尾气:SO2+2NH3+H2O=(NH4)2SO3
B. 除去硝酸工业尾气中的氮氧化合物:NO2+NO+2NaOH=2NaNO2+H2O
C. 制硫酸铜:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D. 制硫酸铜:2Cu+O2![]() 2CuO , CuO+H2SO4(稀)=CuSO4+H2O
2CuO , CuO+H2SO4(稀)=CuSO4+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于过滤操作的描述,不正确的是
A. 滤纸应紧贴漏斗内壁并用少量水润湿,使滤纸与漏斗壁之间没有气泡
B. 漏斗内的过滤液的液面应高于滤纸边缘
C. 要沿着玻璃棒慢慢向漏斗中倾倒过滤液
D. 漏斗下端管口应紧靠烧杯内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(稀溶液混合时体积可直接相加)。下列判断错误的是
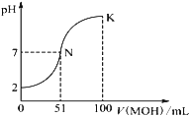
A. 由图中信息可知,HA一定是强酸
B. 当V(MOH)=50.00 mL时,混合溶液中c(M+)+c(MOH)=0.01 mol·L-1
C. N点对应的溶液中c(M+)=c(A-)
D. K点所对应的溶液中离子浓度大小关系为:c(M+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如图所示,下列有关该物质的说法正确的是( )
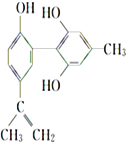
A. 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B. 该分子中的所有碳原子一定共平面
C. 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为4 mol、7 mol
D. 滴入KMnO4酸性溶液,观察到紫色褪去,能证明结构中存在碳碳双键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com