
分析 根据PV=nRT可知:P=$\frac{nRT}{V}$=$\frac{\frac{m}{M}RT}{V}$=$\frac{ρRT}{M}$,则在同温同密度条件下,CH4气体与氧气的压强与摩尔质量成反比,据此进行计算.
解答 解:根据PV=nRT可知:P=$\frac{nRT}{V}$=$\frac{\frac{m}{M}RT}{V}$=$\frac{ρRT}{M}$,说明在同温同密度条件下,CH4与O2的压强与其摩尔质量成反比,则CH4与O2的压强之比=32g/mol:16g/mol=2:1,
故答案为:2:1.
点评 本题考查了物质的量计算,题目难度不大,正确推断在同温同密度条件下压强与摩尔质量的关系为解答关键,试题培养了学生的分析能力及逻辑推理能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | D | E | G | I | J | K |
| 化合价 | -1 | -2 | +4 -4 | -1 | +5 -3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | 常温下B元素的单质能与K单质反应 | |
| B. | A、I、J的离子半径由大到小顺序是A>J>I | |
| C. | G元素的单质存在同素异形体 | |
| D. | J在DB2中燃烧生成B元素的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NH4HSO3溶液中,加入过量的氢氧化钠溶液,并加热:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 向FeBr2溶液中通入过量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| C. | FeCl3溶液与Cu的反应:Cu+2Fe3+=Cu2++2Fe2+ | |
| D. | 向次氯酸钠溶液中通入少量SO2气体:2ClO-+SO2+H2O=2HClO+SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以惰性电极电解饱和食盐水阴极:Na++e-═Na | |
| B. | 用铜电极电解CuSO4溶液)阳极:Cu═Cu2++2e- | |
| C. | 以惰性电极电解熔融NaCl阴极:Na++e-═Na | |
| D. | 以惰性电极电解NaOH溶液阳极:4OH-═2H2O+O2↑+4e- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 25mL 0.5mol/L HCl溶液 | B. | 200mL 0.5mol/L KCl溶液 | ||
| C. | 50mL 1mol/L NaCl溶液 | D. | 100mL 0.5mol/L MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金属氧化物 氧化铁 FeO | B. | 酸性氧化物 二氧化硫 SO2 | ||
| C. | 酸 硫酸 H2SO4 | D. | 碱 纯碱 Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na$→_{点燃}^{O_{2}}$Na2O$\stackrel{H_{2}O}{→}$NaOH | |
| B. | FeS2$→_{煅烧}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | SiO2$\stackrel{NaOH溶液}{→}$Na2SiO3溶液$\stackrel{盐酸}{→}$H2SiO3 | |
| D. | MgCO3$\stackrel{盐酸}{→}$MgCl2溶液$\stackrel{点解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解由X、Y、Z形成的化合物的水溶液,电解后溶液的pH值一定增大 | |
| B. | 由X、Y、Z形成的化合物的分子式一定为X2YZ3 | |
| C. | 由X、Y、Z形成的化合物的水溶液可能呈酸性、中性或碱性 | |
| D. | X元素形成的单质晶体可能为金属晶体,Y、Z两元素形成的单质晶体一定为分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
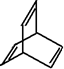 的有机物X的说法不正确的是( )
的有机物X的说法不正确的是( )| A. | X的化学式为C8H8 | |
| B. | 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为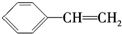 | |
| C. | X能使酸性高锰酸钾溶液褪色 | |
| D. | X与足量的H2在一定条件下反应可生成环状饱和烃Z,Z的一氯代物有4种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com