
在实验室里进行物质制备,下列从原料及有关试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是( )
A.C CO
CO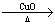 CO2
CO2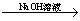 Na2CO3溶液
Na2CO3溶液
B.Cu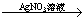 Cu(NO3)2溶液
Cu(NO3)2溶液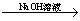 Cu(OH)2
Cu(OH)2
C.Fe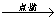 Fe2O3
Fe2O3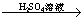 Fe2(SO4)3溶液
Fe2(SO4)3溶液
D.CaO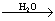 Ca(OH)2溶液
Ca(OH)2溶液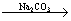 NaOH溶液
NaOH溶液
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
对于可逆反应H2(g)+I2(g)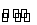 2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )
2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )
A.H2(g)的消耗速率与HI(g)的生成速率比为2∶1
B.正反应速率不再改变时,表示反应达到平衡
C.正、逆反应速率的比值是恒定的
D.达到平衡时,正、逆反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
磷酸铁(FePO4·2H2O,难溶于水的米白色固体)可用于生产药物、食品添加剂和锂离子电池的正极材料。实验室可通过下列实验制备磷酸铁。
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤。反应加热的目的是________________________。
(2)向滤液中加入一定量H2O2氧化Fe2+。为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式如下:
Cr2O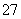 +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
①在向滴定管中注入K2Cr2O7标准溶液前,滴定管需要检漏、________和________。
②若滴定x mL滤液中的Fe2+,消耗a mol·L-1K2Cr2O7标准溶液b mL,则滤液中c(Fe2+)=________mol·L-1。
③为使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是________(填序号)。
A.加入适当过量的H2O2溶液
B.缓慢滴加H2O2溶液并搅拌
C.加热,使反应在较高温度下进行
D.用氨水调节溶液pH=7
(3)将一定量的Na2HPO4溶液(溶液显碱性)加入到含有Fe3+的溶液中,搅拌、过滤、洗涤、干燥得到FePO4·2H2O。若反应得到的FePO4·2H2O固体呈棕黄色,则磷酸铁中混有的杂质可能为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列推断正确的是( )
| 选项 | 事实 | 结论 |
| A | 常温下铁、铜均不溶于浓硫酸 | 常温下铁、铜与浓硫酸均不反应 |
| B | HCl与Na2CO3溶液反应生成CO2 | 可用饱和Na2CO3溶液除去CO2中的少量HCl |
| C | 氧化铜高温下生成砖红色物质,该物质可与稀硫酸反应 | 氧化铜高温下可分解生成Cu2O |
| D | 稀、浓硝酸分别与铜反应,还原产物分别为NO和NO2 | 稀硝酸氧化性比浓硝酸强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
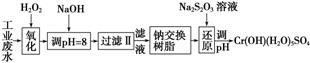
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR—→MRn+nNa+,此步操作被交换除去的杂质离子是__________。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8 mol Cr2O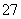 转移4.8 mol e-,该反应离子方程式为________________________________________________________________________。
转移4.8 mol e-,该反应离子方程式为________________________________________________________________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O 形式存在,工业上常用电解法处理含Cr2O
形式存在,工业上常用电解法处理含Cr2O 的废水:
的废水:
该法用Fe作电极电解含Cr2O 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
(1)电解时能否用Cu电极来代替Fe电极?________(填“能”或“不能”),理由是________________________________________________________________________。
(2)电解时阳极附近溶液中Cr2O 转化为Cr3+的离子方程式为__________________________
转化为Cr3+的离子方程式为__________________________
______________________________________________。
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为________时才能使c(Cr3+)降至10-5 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对实验操作或对实验事实的描述正确的是( )
A.用瓷坩埚熔化各种钠的化合物
B.向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象不同
C.配制一定浓度的溶液时,俯视容量瓶的刻线,会使配制的浓度偏低
D.实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在稀盐酸中,然后用蒸馏水稀释并加入少量铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实中,不能用勒夏特列原理解释的是
A.盛有NO2和N2O4 混合气体的烧瓶置于热水中,气体颜色变深
B .工业合
.工业合 成氨选择500oC左右的
成氨选择500oC左右的 温度比室温有利
温度比室温有利
C.实验室中常用排饱和食盐水的方法收集Cl2
D.合成氨时采用循环操作及将氨液化分离,可提高原料的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在一次化学晚会上,一位同学表演了一个有趣的魔术:用蘸有饱和硫酸铜溶液的玻璃棒在一洁净的铁片上点上数处,所点之处,点铁成“金”。你知道其中的奥妙吗?请用化学方程式表示其反应原理:
__________________________________________________________________。
(2)铜在自然界多以+1价矿石存在,因为在固态或是高温下+1价铜比+2价铜稳定。辉铜矿(Cu2S)炼铜的方法之一是将矿石高温通空气焙烧,生成两种氧化物。将焙烧过的矿石加上比它质量约少一半的未经焙烧的矿石,混合后隔绝空气再进行高温熔烧,结果得到金属铜和一种具有刺激性气味的气体。这两个反应的化学方程式为 、 。
(3)已知CuS、Cu2S均为黑色不溶于水的固体,在空气中灼烧均生成CuO与SO2,不用其他试剂,设计最简单的实验来鉴别二者: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com