
| A. | 同周期主族元素,原子半径随原子序数增大而增大 | |
| B. | 第3周期主族元素的最高正化合价等于它所处的主族序数 | |
| C. | 周期表中所含元素种类最多的族是ⅠA族 | |
| D. | 稀有气体元素原子的最外层电子数均为8 |
分析 A.同周期,原子半径从左向右减小;
B.主族元素的最高正化合价=族序数;
C.周期表中所含元素种类最多的族为ⅢB族;
D.He的最外层电子数为2.
解答 解:A.同周期主族元素,原子半径从左向右减小,则原子半径随原子序数增大而减小,故A错误;
B.主族元素的最高正化合价=族序数,则第3周期主族元素的最高正化合价等于它所处的主族序数,故B正确;
C.周期表中所含元素种类最多的族为ⅢB族,含錒系和镧系,故C错误;
D.He的最外层电子数为2,则除He外的稀有气体元素原子的最外层电子数均为8,故D错误;
故选B.
点评 本题考查周期表的结构及应用,为高频考点,把握元素周期表的结构、元素的性质为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:解答题
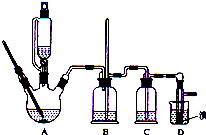 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 处理过程中,PH减小 | B. | 废水处理中,亚硝酸盐被还原 | ||
| C. | 废水处理时铝单质转化为AlO2- | D. | 铝粉颗粒大小影响废水处理的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸) | |
| B. | 为了准确测定反应混合溶液的温度,实验中温度计水银球应一直插入溶液中 | |
| C. | 用0.5 mol•L-1 NaOH溶液分别与0.5mol•L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同 | |
| D. | 为了使反应更完全,可以使酸或碱的浓度适当过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与水反应:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-$\frac{\underline{\;△\;}}{\;}$Mn2++Cl2↑+2H2O | |
| C. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O | |
| D. | Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、MnO4-、Na+、Cl- | B. | Na+、Cl-、NO3-、SO42- | ||
| C. | K+、Na+、NO3-、HCO3- | D. | Fe3+、Na+、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中的反应物,不是氧化剂就是还原剂 | |
| B. | 在氧化还原反应中,还原剂失去电子总数等于氧化剂得到电子的总数 | |
| C. | 能导电的物质一定是电解质 | |
| D. | 金属氧化物一定是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量NaOH固体,电离平衡向正向移动 | |
| B. | 加入少量NaOH固体,溶液中的H+浓度增大 | |
| C. | 加入少量CH3COONa固体,电离平衡向正向移动 | |
| D. | 加入少量CH3COONa固体,溶液中的CH3COO-浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从1L1mol/L的氯化钠溶液中取出10ml,其浓度仍是1mol/L | |
| B. | 将80 g NaOH溶于1 L水中,所得溶液中NaOH的物质的量浓度为2 mol/L | |
| C. | 0.5 L 2mol/L的氯化钡溶液中,钡离子和氯离子总数约为3×6.02×1023 | |
| D. | 10g 98%硫酸(密度为1.84g/cm3)与10mL18.4mol/L硫酸的物质的量浓度是相同的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com