
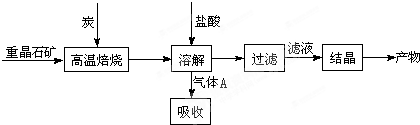
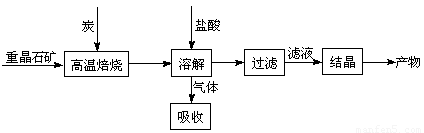
工业上制备BaCl2的工艺流程图如下:

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s)![]() 4CO(g) + BaS(s) △H1 =+ 571.2 kJ·mol-1 ①
4CO(g) + BaS(s) △H1 =+ 571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s)![]() 2CO2(g) + BaS(s) △H2=+ 226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2=+ 226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。一定浓度的硫化钠溶液因向空气中释放臭味而称为“臭碱”,下列对这一现象的解释你认为最合理的是 (填序号)
A.硫化钠在水溶液中水解生成了NaOH和H2S气体
B.硫化钠溶液因吸收空气中的氧气被氧化生成了NaOH,同时生成有臭味的气体
C.硫化钠溶液水解的过程中因吸收空气中的CO2而放出H2S气体
(2)向同物质的量浓度BaCl2和KBr混合溶液中逐滴加入AgNO3溶液,先生成 沉淀,当![]() = 时,开始生成第二种沉淀,随着AgNO3溶液的进一步滴加,此时生成的沉淀以 为主,且
= 时,开始生成第二种沉淀,随着AgNO3溶液的进一步滴加,此时生成的沉淀以 为主,且![]() 会 (填变大、变小、始终不变)。
会 (填变大、变小、始终不变)。
[已知Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s) + CO2(g)![]() 2CO(g)的△H= kJ·mol-1。
2CO(g)的△H= kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是 。
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
| 高温 |
| 高温 |
| c(Br-) |
| c(Cr-) |
| 高温 |
查看答案和解析>>
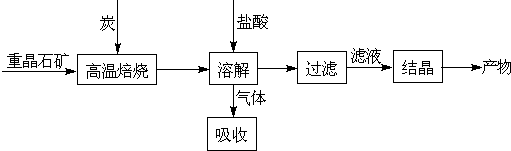
科目:高中化学 来源: 题型:
| ||
| ||
| c(Br-) |
| c(Cl-) |
| ||
查看答案和解析>>
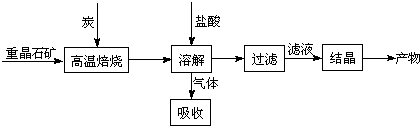
科目:高中化学 来源: 题型:
| 高温 |
| 高温 |
| 高温 |
| 光合作用 |
| 催化剂 |
| △ |
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
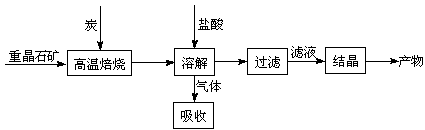
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + ![]() 4CO(g) + BaS(s) △H1 = 571.2 kJ·mol-1 ①
4CO(g) + BaS(s) △H1 = 571.2 kJ·mol-1 ①
BaSO4(s) + ![]() 2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1 ②
⑴气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
⑵向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,![]() = 。
= 。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
⑶反应C(s) + CO2(g)![]() 2CO(g)的△H= kJ·mol-1。
2CO(g)的△H= kJ·mol-1。
⑷实际生产中必须加入过量的炭,同时还要通入空气,其目的是 , 。
查看答案和解析>>
科目:高中化学 来源:2015届吉林省白山市高二上学期期末考试化学试卷(解析版) 题型:填空题
工业上制备BaCl2的工艺流程图如下:
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s) + 4C(s)  4CO(g) + BaS(s) △H1 =+571.2 kJ·mol-1 ①
4CO(g) + BaS(s) △H1 =+571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s)  2CO2(g) + BaS(s) △H2=+226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2=+226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,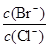 =
。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
=
。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s) + CO2(g)  2CO(g)的△H=
kJ·mol-1。
2CO(g)的△H=
kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com