
| A、该反应的反应热△H2>0 |
| B、N2分子比 N4分子更稳定 |
| C、△H2=2△H1 |
| D、△H2与方程式系数无关 |


科目:高中化学 来源: 题型:
| A、对于吸热反应,反应物所具有的总能量总是低于生成物所具有的总能量 |
| B、任何放热反应在常温条件下一定能发生反应 |
| C、形成生成物化学键释放的能量大于破坏反应物化学键所吸收的能量时,反应为吸热反应 |
| D、等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤⑥ | B、②④ |
| C、②③④⑥ | D、①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④ | B、②③④ |
| C、①⑥ | D、②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol CO2 的质量为44g/mol |
| B、NA个CO2的质量与CO2的相对分子质量在数值上相同 |
| C、CO2的摩尔质量为44g/mol |
| D、CO2的摩尔质量等于CO2的相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
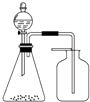 利用如装置能制取并收集到相应气体的是( )
利用如装置能制取并收集到相应气体的是( )| A、浓氨水与固体CaO制氨气 |
| B、浓盐酸与KClO3固体制氯气 |
| C、稀硝酸与铜片制NO |
| D、饱和食盐水与电石制乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、.1:2 | B、.1:5 |
| C、.5:1 | D、2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
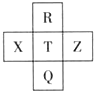 五种元素在元素周期表中的相对位置如图所示,其中非金属元素X的单质是淡黄色晶体.下列判断不正确的是( )
五种元素在元素周期表中的相对位置如图所示,其中非金属元素X的单质是淡黄色晶体.下列判断不正确的是( )| A、Z为Cl |
| B、非金属性:X<T |
| C、原子半径:R<T<Q |
| D、最高价氧化物的水化物的酸性:T>Q |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)电镀时,镀件与电源的
(1)电镀时,镀件与电源的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com