
| A. | 常温下,能稳定存在的R的高价氧化物都能与烧碱溶液反应 | |
| B. | R的最高价氧化物对应水化物是强酸 | |
| C. | R和R的氧化物的熔点和硬度都很高 | |
| D. | R能形成稳定的气态氢化物 |
分析 设原子最外电子层上达到饱和所需电子数为x,则R的电子排布是2,8,8-x,其中x是2的倍数,但又小于8-2=6,则x可为2或4,当x=2时,R为S,当x=4时,R为Si,结合对应单质、化合物的性质解答该题.
解答 解:设原子最外电子层上达到饱和所需电子数为x,则R的电子排布是2,8,8-x,其中x是2的倍数,但又小于8-2=6,则x可为2或4,当x=2时,R为S,当x=4时,R为Si,
A.SO2、SiO2都是酸性氧化物,都可以与烧碱反应,故A正确;
B.对应的最高价氧化物对应的水化物中,硅酸是弱酸、硫酸是强酸,故B错误;
C.Si、SiO2是原子晶体,硅和二氧化硅的熔点和硬度很高,而S单质、二氧化硫是分子晶体,其熔点和硬度不大,故C错误;
D.硅的氢化物SiH4,硅烷的稳定性较差,故D错误;
故选A.
点评 本题考查原子结构与元素的性质,题目难度中等,解答本题注意把握原子结构特点,推断出元素种类的可能性,学习中要把握常见物质的性质,试题培养了学生的分析能力及逻辑推理能力.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 7.8 g Na2O2与足量水反应转移的电子数为0.1NA | |
| B. | 常温常压下,22.4LCH4中含有的氢原子数为4NA | |
| C. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.2NA | |
| D. | 12.0 g熔融的NaHSO4中含有0.1NA个Na+、0.1NA个H+和0.1NA个SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与Fe、Br2混合 | B. | 氯乙烷和NaOH溶液共热 | ||
| C. | 溴乙烷和NaOH的乙醇溶液共热 | D. | 乙烯和溴水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑥⑦ | B. | ①④⑤ | C. | ③⑥⑦⑧ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与稀盐酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与二氧化碳的反应 | D. | 盐酸在烧碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在离原子核越近的区域运动的电子,能量越低 | |
| C. | 1869年俄国化学家门捷列夫经研究提出了元素周期律,并列出了第一张元素周期表 | |
| D. | 因为一个铝原子比一个钠原子失去电子数目多,所以铝单质比钠单质还原性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
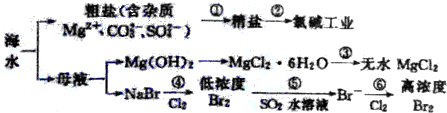
| A. | 过程①的提纯只有物理过程,过程②通过氧化还原反应可产生两种单质 | |
| B. | 在过程③中将MgCl2•6H2O直接灼烧即可制得纯净无水MgCl2 | |
| C. | 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题 | |
| D. | 过程⑥所得的高浓度溴水只需分液即可获得液溴 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com