
【题目】汽车的启动电源常用蓄电池。其结构如下图所示,放电时其电池反应如下:PbO2+Pb+2H2SO4===2PbSO4+2H2O。根据此反应判断,下列叙述中不正确的是
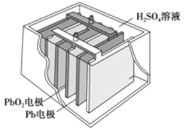
A. Pb作为负极,失去电子,被氧化
B. PbO2得电子,被还原
C. 负极反应是Pb+SO42--2e-===PbSO4
D. 电池放电时,溶液酸性增强
 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A. 用石墨作电极电解CuCl2溶液:2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
B. 0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
C. 将少量二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O
D. Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,5种银盐的溶度积常数(Ksp)分别是:
AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
1.8×10-10 | 1.4×10-5 | 6.3×10-50 | 7.7×10-13 | 8.51×10-16 |
下列说法不正确的是
A. 氯化银、溴化银和碘化银的溶解度依次减小
B. 将硫酸银溶解于水后,向其中加入少量硫化钠固体,能得到黑色沉淀
C. 在5mL1.5×10-5mol/L的NaCl溶液中,加入1滴(1mL约20滴)1.0×10-3mol/L的AgNO3溶液,不能观察到白色沉淀
D. 在烧杯中放入6.24g硫酸银固体,加200g水,经充分溶解后,所得饱和溶液的体积为200mL,溶液中Ag+的物质的量浓度为0.2mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X(g)+3Y (g)![]() 2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与1mol Y (g),下列说法正确的是
2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与1mol Y (g),下列说法正确的是
A. 充分反应后,放出热量为a kJ
B. 当反应达到平衡状态时,X与W的物质的量浓度之比一定为1:2
C. 当X的物质的量分数不再改变,表明该反应已达平衡
D. 若增大Y的浓度,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别取浓度不同、体积均为20.00mL的3种HCl溶液,分别滴入浓度为1.000mol·L-1,0.1000mol·L-1和0.01000mol·L-1的NaOH溶液,测得3个反应体系的pH随V(NaOH)的变化的曲线如图,在V(NaOH)=20.00mL前后出现突跃。下列说法不正确的是
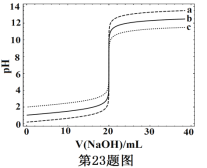
A. 3种HCl溶液的c(HCl):最大的是最小的100倍
B. 曲线a、b、c对应的c(NaOH):a>b>c
C. 当V(NaOH)=20.00mL时,3个体系中均满足:c(Na+)=c(Cl-)
D. 当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果不正确的是
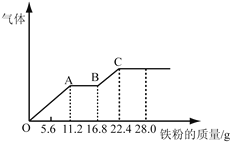
A. 混合酸中HNO3物质的量浓度为2mol/L
B. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C. 原混合酸中H2SO4物质的量为0.4 mol
D. 第二份溶液中最终溶质为FeSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下述为制取Cu2O的两种方法:
方法a:用炭粉在高温条件下还原CuO
方法b:电解法,反应为2Cu+H2O![]() Cu2O+H2↑
Cu2O+H2↑
(1)已知:①2Cu(s)+![]() O2(g)=Cu2O(s)△H1=akJ/mol
O2(g)=Cu2O(s)△H1=akJ/mol
②C(s)+![]() O2(g)=CO(g) △H2=bkJ/mol
O2(g)=CO(g) △H2=bkJ/mol
③Cu(s)+![]() O2(g)=CuO(s)△H3=ckJ/mol
O2(g)=CuO(s)△H3=ckJ/mol
则方法a中反应的热化学方程式是:_________________。
(2)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度而制备纳米Cu2O装置如图所示:
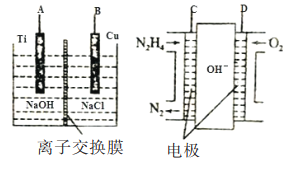
①如图装置中D电极应连______电极。(填“A”或“B”)
②该离子交换膜为______离子交换膜(填“阴”或“阳”),该电解池的B极反应式为:______。
③C极反应式为:__________。
(3)在相同体积的恒容密闭容器中,用以上方法制得的两种Cu2O分别进行催化分解水的实验:
2H2O![]() 2H2(g)+O2(g) △H>0,水蒸气的浓度随时间t变化如表所示:
2H2(g)+O2(g) △H>0,水蒸气的浓度随时间t变化如表所示:
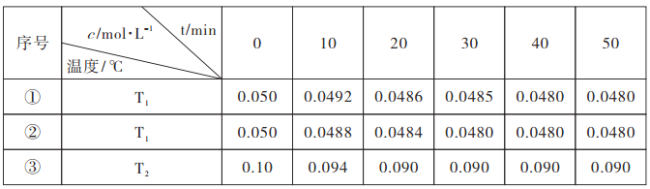
根据上述数据分析:
①催化剂的效率:实验①_______实验②(填“>”或“<”);
②通过实验①、③分析,T1______T2(填“>”或“<”);
③实验①、②、③的化学平衡常数K1、K2、K3的大小关系为:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B3C+4D中,表示该反应速率最快的是( )
A. υ(A)=0.5molL1S1 B. υ(B)=0.3 molL1S1
C. υ(C)=1.2molL1min1 D. υ(D)=0.6 molL1min1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硒(Se)的保健品已开始进入市场。已知硒与氧、硫同主族,与溴同周期,则下列关于硒的叙述中,正确的是
A.非金属性比硫强B.原子序数为34
C.氢化物比HBr稳定D.最高价氧化物的水化物显碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com