
| A、反应前HNO3溶液的浓度为2.0mol?L-1 |
| B、1.12L的气体全部为NO |
| C、反应后溶液中c(NO3-)=1.6mol?L-1 |
| D、反应后的溶液最多还能溶解1.61g Fe |
| 2.8g |
| 56g/mol |
| 1.12L |
| 22.4L/mol |
| 0.21mol |
| 0.1L |
| 2.8g |
| 56g/mol |
| 1.12L |
| 22.4L/mol |
| 0.05mol |
| 0.1L |
| 3 |
| 8 |


科目:高中化学 来源: 题型:
| A、该溶液一定呈酸性 |
| B、该溶液一定呈碱性 |
| C、该溶液中c(OH-)一定为0.1mol/L |
| D、该溶液中c(H+)约为1×10-1mol/L或1×10-13mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加稀盐酸产生无色无味气体,将气体通入澄清石灰水,石灰水变浑浊,原溶液可能含CO32- |
| B、加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀消失,原溶液一定含有SO42- |
| C、加入AgNO3溶液有白色沉淀产生,原溶液一定含有Cl- |
| D、加入Na2CO3溶液有白色沉淀产生,再加盐酸,白色沉淀消失,原溶液中一定含有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、降低温度 |
| B、增大压强 |
| C、升高温度同时充入N2 |
| D、及时将C02和N2从反应体系中移走 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水玻璃与硅胶均属于酸 |
| B、漂白液与漂粉精的主要成分均为钠盐 |
| C、NO2、SO3均属于酸性氧化物 |
| D、醋酸、一水合氨均属于弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
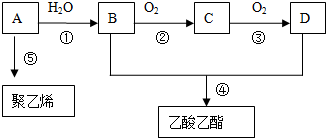
查看答案和解析>>
科目:高中化学 来源: 题型:
| 性质 | 亚硝酸钠 | 氯化钠 |
| 1.酸性条件下的稳定性 | 微热分解为NO和NO2 | 微热时不分解 |
| 2.熔点 | 271℃ | 801℃ |
| 3.室温时的溶解度 | 约80g | 约35g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com