
下列物质中属于原子晶体的化合物是( )?
A.金刚石 B.石英 C.干冰 D.金属金
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:
 (2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构如右图所示,它的化学式是
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构如右图所示,它的化学式是查看答案和解析>>
科目:高中化学 来源: 题型:
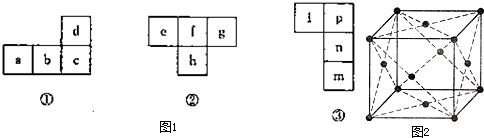
| 1 | 3 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省平顶山市高二下学期期末考试理科综合化学试卷(带解析) 题型:填空题
[化学——选修物质结构与性质](30分)
Ⅰ.(18分)请选出下列各题中符合题意的选项:
(1)下列物质中,属于含有共价键的离子晶体是
A.CsCl B.KOH C.H2O D.H2
(2)已知CsCl晶体的密度为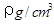 ,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的摩尔质量可以表示为
,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的摩尔质量可以表示为 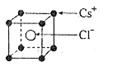
A.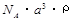 g/mol B.
g/mol B.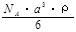 g/mol
g/mol
C.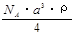 g/mol D.
g/mol D. g/mol
g/mol
(3)已知含氧酸可用通式XOm(OH)n来表示,如X是S,m=2,n=2,则这个式子就表示H2SO4。一般而言,该式中m的值越大,该含氧酸的酸性越强。下列各含氧酸中酸性最强的是
A.HMnO4 B.H2SeO3 C.H3BO3 D.H3PO4
Ⅱ.(12分)现有部分前四周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| A | 原子的电子排布图为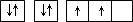 |
| B | 常温下单质为双原子分子,原子间形成三对共用电子对 |
| C | 原子的s轨道电子数等于p轨道电子数,元素的最低负价为-2价 |
| D | 二价阳离子与C的阴离子具有相同的电子层结构 |
| E | 原子序数是D两倍, |

查看答案和解析>>
科目:高中化学 来源:2013届河南省平顶山市高二下学期期末考试理科综合化学试卷(解析版) 题型:填空题
[化学——选修物质结构与性质](30分)
Ⅰ.(18分)请选出下列各题中符合题意的选项:
(1) 下列物质中,属于含有共价键的离子晶体是
A.CsCl B.KOH C.H2O D.H2
(2)已知CsCl晶体的密度为 ,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的摩尔质量可以表示为
,NA为阿伏加德罗常数,相邻的两个Cs+的核间距为a cm,如图所示,则CsCl的摩尔质量可以表示为

A.  g/mol B.
g/mol B. g/mol
g/mol
C.  g/mol D.
g/mol D. g/mol
g/mol
(3)已知含氧酸可用通式XOm(OH)n来表示,如X是S,m=2,n=2,则这个式子就表示H2SO4。一般而言,该式中m的值越大,该含氧酸的酸性越强。下列各含氧酸中酸性最强的是
A.HMnO4 B.H2SeO3 C.H3BO3 D.H3PO4
Ⅱ.(12分)现有部分前四周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
A |
原子的电子排布图为 |
|
B |
常温下单质为双原子分子,原子间形成三对共用电子对 |
|
C |
原子的s轨道电子数等于p轨道电子数,元素的最低负价为-2价 |
|
D |
二价阳离子与C的阴离子具有相同的电子层结构 |
|
E |
原子序数是D两倍, |
根据以上情况,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 ;
(2)B的氢化物的分子空间构型是 ;
(3)E在周期表中的位置是 ,ECl3能与B、C的氢化物形成配位数为6的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界,ECl3形成的配合物的化学式为 ;
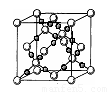
(4)AC2在高温高压下所形成的晶胞如右图所示。该晶体的类型属于 (选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中A原子的杂化形式为 ;
(5)D 的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因: 。
查看答案和解析>>
科目:高中化学 来源:期末题 题型:填空题
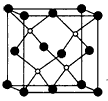
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com