
| A. | 一定物质的量浓度的溶液配制过程中,仰视定容,所得溶液的浓度偏大 | |
| B. | 相同体积和相同物质的量浓度的不同溶液里所含溶质的物质的量相同 | |
| C. | 溶液中溶质质量分数为w,密度为ρ g/cm3,溶质摩尔质量为M g/mol的溶液的物质的量浓度为$\frac{pw}{M}$mol/L | |
| D. | 10 mol/L的浓盐酸与H2O等质量混合所得混合液的浓度为5 mol/L |
分析 B.根据n=cV判断;
D.稀盐酸密度小于浓盐酸密度,稀盐酸质量为浓盐酸质量的2倍,则稀盐酸体积大于浓盐酸体积的2倍;
C.根据c=$\frac{1000ρW}{M}$计算;
A.定容仰视,液面在刻度线上方,配制溶液体积偏大.
解答 解:A.定容仰视,液面在刻度线上方,配制溶液体积偏大,所配溶液浓度偏小,故A错误;
B.相同体积和相同物质的量浓度的不同溶液,根据n=cV可知所含溶质的物质的量相同,故B正确;
C.溶液中溶质质量分数为w,密度为ρ g•cm-3,溶质摩尔质量为M g•mol-1,根据c=$\frac{1000ρw}{M}$可知,溶液的物质的量浓度为$\frac{1000ρw}{M}$mol/L,故C错误;
D.稀盐酸密度小于浓盐酸密度,稀盐酸质量为浓盐酸质量的2倍,则稀盐酸体积大于浓盐酸体积的2倍,故所得混合液的浓度小于5 mol/L,故D错误;
故选:B.
点评 本题考查物质的量浓度有关计算、一定物质的量浓度溶液配制误差分析,注意理解掌握物质的量浓度与质量分数关系.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA | |
| B. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA | |
| C. | 1molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 标准状况下,2.24LCC14含有的共价键数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
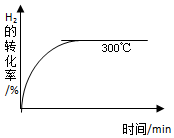 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠、镁等金属着火,不可用CO2灭火 | |
| B. | 在气体发生装置上点燃氢气等气体时,必须先检验气体的纯度 | |
| C. | 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 | |
| D. | 给试管中的液体加热时,不停沿试管倾斜方向移动试管或加入碎瓷片,以免液体暴沸伤人 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com