
| A. | 该反应条件下,初始时向容器中充入2molSO2和1molO2,反应平衡时,可以释放198.0 kJ的热量 | |
| B. | 达到平衡时,SO2和SO3的浓度一定相等 | |
| C. | 反应体系中,当混合物的密度保持不变,反应达到平衡 | |
| D. | 增大压强和升高温度有利于加快反应速率,但升高温度对平衡转化率不利 |
分析 A.可逆反应不能完全转化;
B.转化率和起始浓度未知,不能确定平衡时浓度是否相等;
C.密度始终不变,则密度不变不能说明一定达平衡;
D.增大压强、升高温度反应速率都加快,增大压强平衡向气体体积缩小的方向移动,升温向吸热方向移动.
解答 解:A.可逆反应不能完全转化,则在上述条件下,2molSO2和1molO2混合反应,放出的热量小于198.0kJ,故A错误;
B.转化率和起始浓度未知,则反应达平衡时,SO2和SO3的浓度关系不确定,能确定的是浓度保持不变,故B错误;
C.容器的体积不变,反应体系中都是气体,气体总质量不变,根据$ρ=\frac{m}{V}$可知反应过程中气体的密度始终不变,不能作为达平衡的标志,故C错误;
D.增大压强、升高温度反应速率都加快,增大压强平衡向气体体积缩小的方向移动即正方向,提高了转化率,升温向吸热方向移动即逆方向移动,降低了转化率,故D正确.
故选D.
点评 本题考查影响化学平衡的因素,注意温度、浓度、压强对反应速率及平衡的影响,注意对选项B的理解,题目难度中等.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 平衡时c(NH3)=5mol/L | |
| B. | 平衡时HI分解率为20% | |
| C. | 混合气体的平均摩尔质量不再发生变化不可以作为判断该反应达到平衡状态的标志 | |
| D. | 平衡后缩小容器体积,NH4I的物质的量增加,I2的物质的量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用丁达尔效应区分溶液和胶体 | |
| B. | 将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个 | |
| C. | Fe(OH)3胶体的电泳实验说明了胶体粒子带有电荷 | |
| D. | 江河入海口三角洲的形成,通常与胶体的性质有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L水中含有6.02×1023个水分子 | |
| B. | 32 g氧气所含的原子数目为2×6.02×1023 | |
| C. | 常温常压下,0.5×6.02×1023个一氧化碳分子所占的体积是11.2 L | |
| D. | 1 molCaCl2溶于水配成1 L溶液,所得溶液中Cl-的物质的量浓度为1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.35mol/L | B. | 0.45mol/L | C. | 0.5mol/L | D. | 0.6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 左盘高 | B. | 右盘高 | C. | 仍保持平衡 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用如图装置,可以在室温和一个标准大气压条件下测定镁的相对原子质量.
利用如图装置,可以在室温和一个标准大气压条件下测定镁的相对原子质量.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
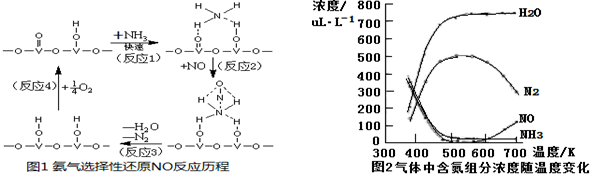
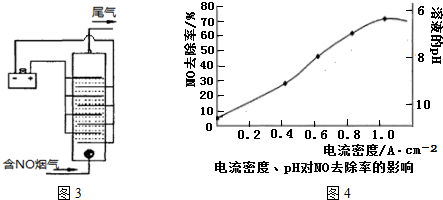
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com