
| A. | Mg和Al | B. | Zn和Cu | C. | Al和Zn | D. | Al和Cu |
分析 假设金属均为+2价,金属总物质的量等于氢气物质的量,根据n=计算混合金属平均摩尔质量;因为为两种金属的混合物,故平均摩尔质量应介于各组分之间,根据电子转移守恒,若金属不与盐酸反应,其摩尔质量可以视作无穷大;Al为+2价时的摩尔质量为:×2=18g/mol,据此进行解答.
解答 解:标况下11.2L氢气物质的量为:=0.5mol,
假设金属均为+2价,金属总物质的量等于氢气物质的量,
故混合金属平均摩尔质量为:=30g/mol,因为为两种金属的混合物,故该平均摩尔质量应介于各组分之间,
A.Mg的摩尔质量为24g/mol,Al为+2价时的摩尔质量为:×2=18g/mol,二者的摩尔质量都小于30g/mol,不可能为二者的组合,故A正确;
B.Cu不与盐酸反应,其摩尔质量可以视作无穷大;锌的摩尔质量为65g/mol,二者的摩尔质量都大于30g/mol,不可能为二者的组合,故B正确;
C.Al为+2价时的摩尔质量为:×2=18g/mol,锌的摩尔质量为65g/mol,二者的平均摩尔质量可以为30g/mol,故C错误;
D.Cu不与盐酸反应,其摩尔质量可以视作无穷大,Al为+2价时的摩尔质量为:×2=18g/mol,可以为二者的组合,故D错误;
故选AB.
点评 本题考查混合物反应的计算,题目难度中等,注意明确金属与酸反应的实质,熟练掌握平均摩尔质量在化学计算中的应用方法,试题充分考查了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| 编号 | ① | ② | ③ |
| 分散质 | Mg(OH)2 | HCl | NH4Cl |
| 备注 | 悬浊液 | 1mol/L | 1mol/L |
| A. | 向①中加入②,c(OH-)减小,Mg(OH)2溶解平衡正向移动 | |
| B. | 向①中加入酚酞显红色,说明物质的“不溶性”是相对的 | |
| C. | 向①中加入③,沉淀溶解,说明Mg(OH)2比NH3•H2O更难电离 | |
| D. | ①③混合后发生反应:Mg(OH)2(s)+2NH4+?Mg2++2NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | A | B | C |
| 结构简式 | 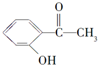 | 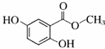 | 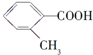 |
| 化合物 | D | E | F |
| 结构简式 |  | 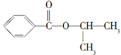 |  |
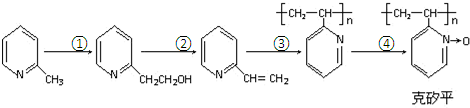
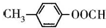 .
.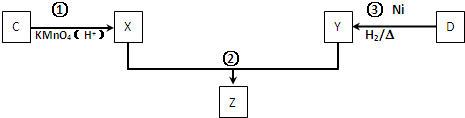
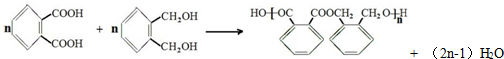 .
.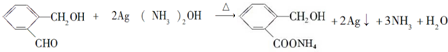 .
.
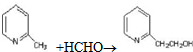 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol氯气 | B. | 1mol S | ||
| C. | 含1molHNO3的稀硝酸 | D. | 含1molCuSO4的硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
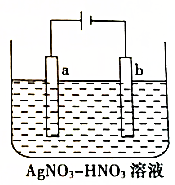 如图为电解精炼银的示意图,a(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为NO3-+e-+2H+=NO2↑+H2O.
如图为电解精炼银的示意图,a(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为NO3-+e-+2H+=NO2↑+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Fe2(SO4)3溶液中加入过量的铁粉,过滤,在滤液中加入过量的NaOH溶液 | |
| B. | 用铁粉与稀硫酸充分反应,然后再加入过量的氨水 | |
| C. | 在FeCl2溶液上加一层苯,然后将滴管插入到FeCl2溶液液面以下,慢慢滴加NaOH溶液(溶液中不能有气泡,配制FeCl2和NaOH溶液的蒸馏水必须加热煮沸) | |
| D. | 在生成Fe(OH)3的悬浊液中加过量的铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验一 | 实验二 | |
| 实验药品 | 4g P2O5、8mL无水乙醇 | |
| 实验条件 | 酒精灯加热 | 水浴加热 |
实验现象 | 无水乙醇加入时,圆底烧瓶B中P2O5溶于乙醇,立即产生白雾,当用酒精灯加热后,有气泡产生,并逐渐沸腾,生成粘稠状液体,集气瓶C中有无色液体产生. | 无水乙醇加入时,圆底烧瓶B中P2O5溶于乙醇立即产生白雾,当用水浴加热后,无气泡产生,生成粘稠状液体,集气瓶C中有无色液体产生. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com