

| 相对分 子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 冬青油 | 152 | 1.180 | 222.2 | 微溶于水 |
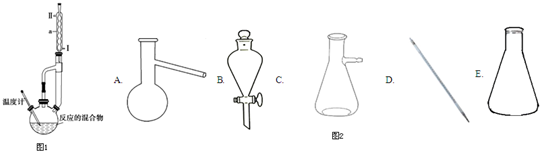
分析 (1)杨酸和甲醇在浓硫酸存在条件下反应制得冬青油的反应是发生的酯化反应,浓硫酸起到催化剂和吸水剂的作用;
(2)分析装置图和仪器形状分析为冷凝管,逆流冷凝效果好;
(3)根据实验基本操作可知,烧瓶中给液体加热需要防止瀑沸,加沸石时溶液要冷却;
(4)加入NaHCO3溶液的目的是降低酯的溶解性,水杨酸,溶解甲醇,便于分层分类得到酯;冬青油密度为1.184g•cm-3,比水溶液重;
(5)粗产品中有水份,需要除去,而无水氯化钙能吸水;
(6)根据蒸馏装置的结构可判断不需要的仪器;
(7)结合反应定量关系计算理论量,产率=$\frac{实际产量}{理论产量}$×100%.
解答 解:(1)杨酸和甲醇在浓硫酸存在条件下反应制得冬青油的反应是发生的酯化反应,反应是可逆反应,浓硫酸具有吸水性促进平衡正向进行,浓硫酸起到催化剂和吸水剂的作用;
故答案为:催化剂、吸水剂;
(2)分析装置图和仪器形状分析为冷凝管,逆流冷凝效果好,应从Ⅱ通入,故答案为:冷凝管;Ⅱ;
(3)根据实验基本操作可知,烧瓶中给液体加热需要防止瀑沸,需加沸石,加沸石时溶液要冷却,故答案为:防止瀑沸;B;
(4)加入NaHCO3溶液的目的是降低酯的溶解性,水杨酸,溶解甲醇,便于分层分类得到酯;冬青油密度为1.184g•cm-3,比水溶液重,
故答案为:将冬青油中的甲醇、水杨酸溶解,便于液体分层;下;
(5)粗产品中有水份,需要除去,而无水氯化钙能吸水,故答案为:除去粗产品中的水分;
(6)根据蒸馏装置的结构可知,装置中不需要要分液漏斗,故选:B;
(7)结合反应定量关系计算理论量,结合反应定量关系计算理论量,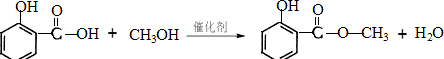
138 152
6.9g m
m=7.6g
产率=$\frac{实际产量}{理论产量}$×100%=$\frac{6.8g}{7.6g}$×100%=89.5%,
故答案为:89.5%.
点评 本题考查了有机物的性质分析和实验制备方法,实验基本操作和有机物性质和反应原理是解题关键,题目难度中等.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:选择题
下列实验“操作和现象”与“结论”对应关系正确的是
操作和现象 | 结论 | |
A | 用玻璃棒蘸取某溶液做焰色反应,可看到黄色火焰 | 溶液中一定有Na+ |
B | 向淀粉溶液中加入稀H2SO4,加热几分钟, 冷却后再加入新制Cu(0H)2浊液,加热,没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
C | 向无水乙醇中加入浓H2SO4,加热至170℃ 产生的气体通入酸性KMnO4溶液,红色褪去 | 使溶液褪色的气体一定是乙烯 |
D | 向某溶液中加稀盐酸无现象,再加入BaCl2溶液,生成白色沉淀 | 该溶液中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制取少量溴乙烷的装置如图所示.
实验室制取少量溴乙烷的装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 完全沉淀的pH | 5.2 | 3.7 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
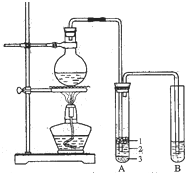
 50mL 0.50mol/L的盐酸和50mL 0.55mol/L的烧碱溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,试回答下列问题:
50mL 0.50mol/L的盐酸和50mL 0.55mol/L的烧碱溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com