
【题目】单萜类化合物香叶醇是香精油的主要成分之一。在酸性溶液中,香叶醇可以转化为环状单萜α—松油醇:
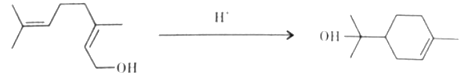
关于香叶醇和α—松油醇,下列说法正确的是( )
A.两者互为同分异构体,分子式是C10H20O
B.两者分子中所有碳原子均处于同一平面
C.两者均能在铜丝催化下和氧气氧化生成醛
D.两者均能使溴的四氯化碳溶液褪色,发生加成反应
科目:高中化学 来源: 题型:
【题目】H是合成有机光电材料的原料。H的一种合成路线如图:
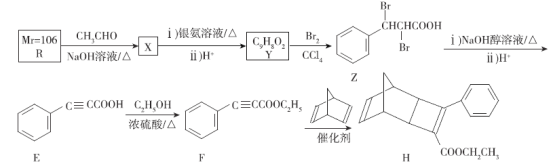
已知:R属于芳香族化合物,与新制Cu(OH)2悬浊液共热产生红色固体。请回答下列问题:
(1)R的化学名称是___________;X中官能团的名称是___________。
(2)F→H的反应类型是___________。
(3)E→F的化学方程式为______________。
(4)检验Z中溴元素的试剂有NaOH溶液、AgNO3溶液和___________。
(5)在Y的同分异构体中,同时具备下列条件的同分异构体有________种(不包含立体异构)。
①能发生银镜反应;②遇氯化铁溶液发生显色反应;③能与溴的四氯化碳溶液发生加成反应。
其中核磁共振氢谱有6组峰且峰面积比为1:1:1:1:2:2的结构简式为_________。
(6)参照上述流程,请设计以一溴环已烷和2-丁炔为起始原料制备![]() 的合成路线:__________(无机试剂任选)。
的合成路线:__________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,用排饱和食盐水法先后收集20mL甲烷和80mL氯气,放在光亮的地方(注意:不要放在日光直射的地方,以免引起爆炸),等待片刻,观察发生的现象。回答下列问题:
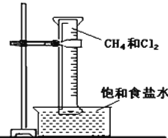
(1)大约30min后,可以观察到量筒内壁出现___________状液体,量筒内液面___________(填“上升”、“下降”或“不变”)。
(2)使1mol甲烷和氯气发生取代反应,生成相同物质的量的四种有机取代物,则需要氯气的物质的量是___________,写出其中常作为有机溶剂和灭火剂的物质的电子式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其合金可用作材料、铝热剂等,在环境修复等方面也有着巨大的应用潜力。
(1)铝的冶炼、提纯的方法很多。
①高温碳热歧化氯化法冶铝包含的反应之一为:Al2O3(s)+AlCl3(g)+3C(s)![]() 3CO(g)+3AlCl(g),其平衡常数表达式为K=_______________。
3CO(g)+3AlCl(g),其平衡常数表达式为K=_______________。
②碳热还原Al2O3冶铝的部分反应如下:
Ⅰ.2Al2O3(s)+9C(s)=Al4C3(s)+6CO(g) △H1=akJ/mol
Ⅱ. 4Al2O3(s)+Al4C3(s)=3Al4O4C(s) △H2=bkJ/mol
Ⅲ. Al4O4C(s)+Al4C3(s)=8Al(g)+4CO(g) △H3=ckJ/mol
反应Al2O3(s)+3C(s)=2Al(g)+3CO(g)的△H=__________kJ/mol
③用离子液体AICb-BMIC(阳离子为EMIM+、阴离子为AlCl4-、Al2Cl7-)作电解质,可实现电解精炼铝。粗铝与外电源的_____________极(填“正”或“负")相连;工作时,阴极的电极反应式为_______________。
(2)真空条件及1173K时,可用铝热还原Li5AlO4制备金属锂(气态),写出该反应的化学方程式:__________________________。
(3)用Al、Fe或Al-Fe合金还原脱除水体中的硝态氮(NO3--N),在45℃,起始c(KNO3-N)为50mg·L-1、维持溶液呈中性并通入Ar等条件下进行脱除实验。结果如图所示(c0为起始浓度、c为剩余浓度):
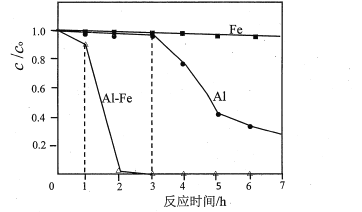
①纯Al在0~3h时,NO3-几乎没有被脱除,其原因是_______________________;写出3h后NO3-被还原为N2的离子方程式:____________________________。
②Al-Fe合金1~2h比纯A13~4h的脱除速率快得多的可能原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青菜含有维生素C和植物纤维有助于清除人体吸入的粉尘颗粒。已知维生素C的结构如图所示,有关判断不正确的是

A. 维生素C中含有3种官能团
B. 维生素C分子式为C6H8O6
C. 维生素C能使酸性高锰酸钾溶液褪色
D. 维生素C在碱性溶液中能稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的反应装置如图所示,步骤之一是将仪器a中浓硝酸和浓硫酸形成的混酸加入到装有苯的三颈烧瓶中,则下列叙述不正确的是( )

A.仪器a的名称是恒压滴液漏斗
B.长玻璃导管可以起到冷凝回流的作用
C.配制混酸时应在烧杯中先加入浓硫酸
D.分离出硝基苯的主要操作是分液和蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍(Ni)及其化合物广泛应用于生产电池、电镀和催化剂等领域。
(1)某蓄电池反应为2NiO(OH)+Cd+2H2O![]() Cd(OH)2+2Ni(OH)2。该蓄电池充电时,被氧化的物质是__(填化学式),放电时若生成73gCd(OH)2,则外电路中转移的电子数是___。
Cd(OH)2+2Ni(OH)2。该蓄电池充电时,被氧化的物质是__(填化学式),放电时若生成73gCd(OH)2,则外电路中转移的电子数是___。
(2)镍的羰化反应为:Ni(s)+4CO(g)![]() Ni(CO)4(g) ΔH。
Ni(CO)4(g) ΔH。
①一定温度下,将一定量的粗镍和CO加入到1L的恒容密闭容器中反应,5s后测得Ni(CO)4的物质的量为1.5mol,则0~5s内平均反应速率v(CO)=__mol·L·s-1。
②该反应的平衡常数K随温度升高而减小,则该反应的ΔH__0(填“>”或“<")。
(3)NiSO4·6H2O晶体是一种绿色易溶于水的晶体,广泛应用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe等元素)为原料制取。制取步骤如下:
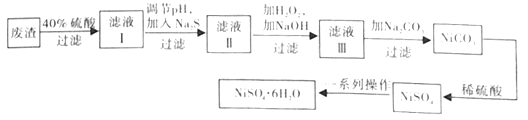
①在实验室中,欲用98%的浓硫酸(密度1.84g·mL-1)配制40%的稀硫酸,需要的玻璃仪器除玻璃棒外,还有__。
②向滤液Ⅰ中加入Na2S的目的是_。(已知:Ksp[FeS]=6.3×10-18,Ksp[CuS]=1.3×10-36,Ksp[ZnS]=1.3×10-24,Ksp[NiS]=1.1×10-21)
③滤液Ⅲ中所含的阳离子主要有__。
④NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH。该反应的离子方程式为__。
⑤在制备NiSO4·6H2O晶体时,常用无水乙醇代替蒸馏水做洗涤剂,原因是__(写出一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有5种无色液态物质:己烯、己烷、苯、甲苯和苯酚符合下列各题要求的分别是:
(1)不与浓溴水反应但能与KMnO4酸性溶液反应的是_______。
(2)在空气中能被氧化成粉红色,该物质是_______。写出该物质与浓溴水反应的化学方程式________。
(3)不能与溴水和KMnO4酸性溶液反应,但在铁屑作用下能与液溴反应的是____,反应的化学方程式为________,此反应属于______反应。
(4)既能与溴水又能与KMnO4酸性溶液反应的烃是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com