
| A. | CaCl2中既含有离子键又含有共价键 | |
| B. | Na0H中既含有离子键又含有共价键 | |
| C. | Na2O2中只含有离子键 | |
| D. | 由非金属元素组成的物质NH4Cl中只有共价键 |
分析 化学键包含共价键、离子键等,金属阳离子和阴离子之间的化学键为离子键,一般盐、碱金属氧化物中含有离子键,非金属元素之间的化学键为共价键,其中相同非金属元素形成的为非极性共价键,不同非金属元素形成的为极性共价键,以此解答该题.
解答 解:A.CaCl2中只含有离子键,故A错误;
B.NaOH为离子化合物,含有离子键,O-H为共价键,故B正确;
C.Na2O2含有离子键和共价键,故C错误;
D.NH4Cl为离子化合物,含有离子键和共价键,故D错误.
故选B.
点评 本题考查化学键与化合物的分类,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重常见物质中化学键的考查,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:解答题
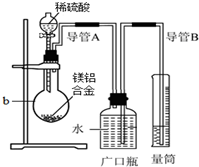 化学学习小组对某镁铝合金进行了如下实验研究,请你参与并完成对有关问题的解答.
化学学习小组对某镁铝合金进行了如下实验研究,请你参与并完成对有关问题的解答.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
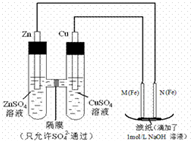 某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.
某课外小组分别用如图所示装置对原电池和电解原理进行实验探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| 坐标对应点 | a | b | c | d |
| n(SO32-):n(HSO32-) | / | 91:9 | 1:1 | 9:91 |
| pH | >8.2 | 8.2 | 7.2 | 6.2 |
| A. | b点溶液中:水电离出的c(OH-)=1×10-5.8mol/L | |
| B. | c点溶液中:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) | |
| C. | d点溶液中HSO3-的电离大于水解 | |
| D. | d点溶液中:c(Na+)<c(SO32-)+c(HSO3-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
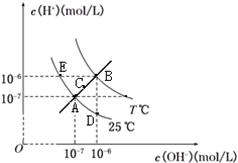
| A. | 图中五点KW间关系:B>C>A=D=E | |
| B. | E点对应的水溶液中,可能有NH${\;}_{4}^{+}$、Ba2+、Cl-、I-、K大量同时存在 | |
| C. | 若处在B点时,将pH=3的硫酸溶液与pH=9的KOH溶液等体积混合,所得溶液呈中性 | |
| D. | 若0.1mol/L的NaHB溶液中c(OH+)与c(OH-)关系如图D点所示,则溶液中有:c(HB-)>c(OH-)>c(B2-)>c(H2B) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Na+<S2-<Cl-<K+ | B. | 还原性:I-<Br-<-Cl<F- | ||
| C. | 稳定性:SiH4<PH3<HCl<HBr | D. | 溶解性:BaO4<CaSO4<MgSO4. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
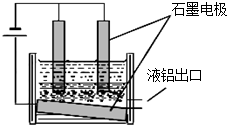 元素铝是在生产、生活中应用广泛的金属元素.
元素铝是在生产、生活中应用广泛的金属元素.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com