
| 选项 | A | B | C | D |
| 实验装置 |  | 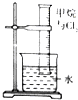 | 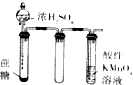 | 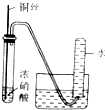 |
| 实验目的 | 提取苯中的Br2 | 探究甲烷的取代反应 | 检验浓硫酸的脱水性和强氧性 | 实验室制备并收集NO2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.溴与氢氧化钠溶液反应;
B.应用饱和食盐水代替水;
C.浓硫酸可使蔗糖碳化,并生成二氧化硫气体;
D.二氧化氮与水反应,且溶于水.
解答 解:A.溴与氢氧化钠溶液反应,分离溴与苯,应用蒸馏的方法,故A错误;
B.氯气难溶于饱和食盐水,应用饱和食盐水代替水,故B错误;
C.浓硫酸可使蔗糖碳化,表现硫酸的脱水性,并生成二氧化硫气体,表现浓硫酸的强氧化性,故C正确;
D.二氧化氮与水反应,且溶于水,不能用排水法收集,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的分离、气体的制备及收集等,侧重实验基本操作和实验技能的考查,注意实验操作的评价性分析,题目难度不大


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
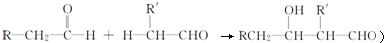 )
)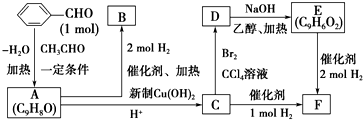
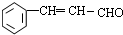 、
、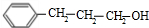 、
、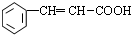 、
、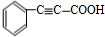 、
、 .
.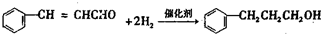 ;
;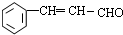 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$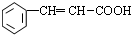 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在合成氨的工业生产中,使用较高温度有利于提高产量 | |
| B. | 在合成氨的工业生产中,加压有利于提高氨的产量 | |
| C. | 木炭粉碎后与O2反应,速率更快 | |
| D. | 由H2(g)、I2(g)、HI气体组成的平衡体系加压后颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=+110.5 kJ•mol-1 | |
| B. | C(s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3、SO2、CO2、SO3 | B. | CO2、Cl2、CaO、SO3 | ||
| C. | Cl2、Al2O3、SO2、SO3 | D. | SiO2、CO2、CO、Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com