
| A. | 2 mol NaOH的摩尔质量为80g/mol | |
| B. | S2和S8的混合物共6.4 g,其中所含硫原子数一定为0.2 NA | |
| C. | 1molNa2O2与足量CO2反应转移的电子数为2NA个 | |
| D. | 0.1molKHSO4晶体中阳离子总数为0.2NA |
分析 A.摩尔质量与物质的量大小无关;
B.S2和S8均由硫原子构成,根据质量守恒计算;
C.1mol过氧化钠与足量二氧化碳反应生成0.5mol氧气,结合过氧化钠中氧元素的化合价为-1计算;
D.硫酸氢钠晶体中含有阳离子只有钾离子.
解答 解:A.NaOH的摩尔质量为40g/mol,与物质的量大小无关,故A错误;
B.S2和S8均由硫原子构成,则6.4g混合物中含有的硫原子的物质的量=$\frac{6.4g}{32g/mol}$=0.2mol,所含硫原子个数为0.2NA个,故B正确;
C.1molNa2O2与足量CO2反应生成0.5mol氧气,根据电子守恒可知转移1mol电子,转移的电子数为NA,故C错误;
D.0.1molKHSO4晶体中含有0.1mol钾离子,含有阳离子总数为0.1NA,故A错误;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
 脱落酸具有催熟作用,可延长鲜花盛开时间,脱落酸的结构简式如图所示,下列说法不正确的是( )
脱落酸具有催熟作用,可延长鲜花盛开时间,脱落酸的结构简式如图所示,下列说法不正确的是( )| A. | 脱落酸在一定条件下能和乙酸发生酯化反应 | |
| B. | 脱落酸分子中含有4个甲基 | |
| C. | 等量脱落酸与足量的NaHCO3、Na反应,放出CO2与H2的物质的量之比为n(CO2):n(H2)=2:1 | |
| D. | 脱落酸能使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCnH2n-2(n≥2)中所含的共用电子对数为(3n+l)NA | |
| B. | 在K37ClO3+6H35Cl(浓)═KCl+3Cl2↑+3H2O反应中,若有212克氯气生成,则反应中电子 转移的数目为5NA | |
| C. | 60 克的乙酸和葡萄糖混合物充分燃烧消耗2NA个O2 | |
| D. | 5.8 g熟石膏(2CaSO4•H2O)含有的结晶水分子数为0.02NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
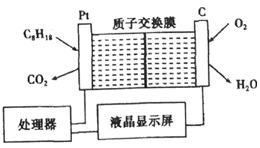 为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法中不正确的是( )
为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法中不正确的是( )| A. | 石墨电极作正极,发生还原反应 | |
| B. | 铂电极的电极反应式为:C8H18+16H2O-50e-═8CO2+50H+ | |
| C. | 每消耗标准状况下5.6 L O2溶液中通过lmol 电子 | |
| D. | H+由质子交换膜左侧向右侧迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O,Fe2O3、A12O3属于碱性氧化物,CO2、SO2、NO2都能和碱溶液发生反应属于酸性氧化物 | |
| B. | CaCl2、NaOH、HCl、HD四种物质都属于化合物 | |
| C. | 蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质 | |
| D. | 醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题


| A.气体M是SO2和H2的混合物 | B.气体M是SO2和H2的体积比为4:1 |
| C.反应中共消耗锌97.5g | D.反应中共转移电子3mol |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图中a表示阳离子交换膜 | |
| B. | 当电路中通过1mol电子的电量时,会有0.25mol的O2生成 | |
| C. | 甲为NaOH溶液 | |
| D. | 阳极的电极反应式为SO32-+H2O-2e-=SO42-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因该反应为放热反应,故不加热就可发生 | |
| B. | 相同条件下,2 mol H2的能量或1 mol CO的能量一定高于1 mol CH3OH的能量 | |
| C. | 相同条件下,反应物H2和 CO的总能量一定高于生成物CH3OH的总能量 | |
| D. | 达到平衡时,CO的浓度与CH3OH的浓度一定相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com