
下列关于强、弱电解质的叙述,有错误的是( )
A.强电解质在溶液中完全电离,不存在电离平衡
B.纯净的强电解质在液态时,有的导电,有的不导电
C.同一弱电解质的溶液,当温度、浓度等不同时,其导电能力也不同
D.在溶液中,导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质
 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源:2016-2017学年河南省郏县一高、叶县二高等五校高二上期中化学卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A.NaHS水解反应:HS-+H2O H3O++S2-
H3O++S2-
B.明矾加入在水中起净化作用的原因:Al3++3H2O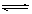 Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
C.氢氧化钡溶液与稀硫酸反应: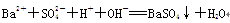
D.碳酸氢钠溶液中加入过量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高一上学期期中化学试卷(解析版) 题型:选择题
下列反应中不属于氧化还原反应的是
A.3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S↓+4H2O
B.3Cl2+6KOH=5KCl+KClO3+3H2O
C.3CCl4+K2Cr2O7=2CrO2C12+3COCl2+2KCl
D.2KMnO4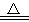 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上学期期中化学试卷(解析版) 题型:实验题
(1)50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。通过测定反应过程中 所放出的热量可计 算中和热。回答下列问题:
算中和热。回答下列问题:
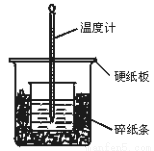
①从实验装置上看,图中尚缺少的一种玻璃用品是__________________。
②实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH 溶液进行反应,与上述实验相比,所求的中和热_________(填“相等”或“不相等”)。
(2)①如图Ⅰ 表示10 mL量筒中液面的位置。A与B,B与C刻度间相差1 mL,如果刻度A为6,量筒中液体的体积是________mL。
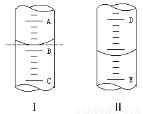
②图Ⅱ表示50 mL滴定管中液面的位置。如果液面处的读数是a,则滴定管中液体的体积(填代号)________。
A.是a mL B.一定大于a mL
C.是(50-a) mL D.一定大于(50-a) mL
(3)已知KMnO4、MnO2在酸性条件下均能将草酸 (H2C2 O4)氧化:
O4)氧化:
(i)MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)
(ii)MnO2+H2C2O4+2H+=Mn2++2CO2↑+2H2O
某研究小组为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入1.80g草酸,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液转移到容量瓶中并定容;从中取出25.00mL待测液置于锥形瓶中,再用0.020mol·L-1KMnO4标准溶液进行滴定,当滴入20.00mLKMnO4溶液时恰好完全反应。试回答下列问题:
① 方程式(i)配平后H2C2O4的计量系数为 。
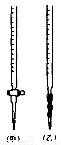
② 0.020mol·L-1KMnO4标准溶液应置于 (填“甲”或“乙”)滴定管中;滴定终点的颜色变化是 。
③ 你能否帮助该研究小组求得软锰矿中MnO2的质量分数;若“能”,请给出计算结果;若“否”,试说明原因。“能”的计算结果或“否”的原因说明 。
④若在实验过程中存在下列操作,其中会使所测MnO2的质量分数偏小的是 。
A.滴定前尖嘴部分有一气泡,滴定终点时消失
B.溶液转移至容量瓶中,未将烧杯、玻棒洗涤
C.滴定前仰视读数,滴定后俯视读数
D.定容时,俯视刻度线
E.锥形瓶水洗之后未用待测液润洗
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上学期期中化学试卷(解析版) 题型:选择题
在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0
CO2(g)+H2(g) ΔH<0
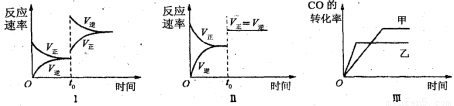
下列分析中不正确的是( )
A.图Ⅰ研究中的是t0时升高温度对反应速率的影响
B.图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二上学期期中化学试卷(解析版) 题型:填空题
一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO (g) 十H2O (g)  CO2 (g) 十 H2 (g) ; △H<0
CO2 (g) 十 H2 (g) ; △H<0
(1)在850℃时,CO和H2O浓度变化如下左图,则 0~4min的平均反应速率v(CO2)= _ mol·L-1·min-1

(2)t1℃时,在相同容器中发生上述反应,各物质的浓度变化如右上表:
① 计算t1℃该反应的平衡常数为K = 。
② t1℃时,反应在5min~6min间,平衡 移动(填向左、向右或不 ),若在第5分钟改变一种条件达到第6分钟的浓度,改变的条件是 。
(3)t2℃时,化学反应CO (g) + H2O (g)  CO2 (g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃ 850℃, 判断依据是:
CO2 (g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃ 850℃, 判断依据是:
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二上学期期中化学试卷(解析版) 题型:选择题
常温下,用0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1CH3COOH溶液所得滴定曲线如下图。下列说法正确的是( )
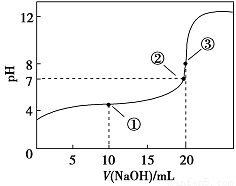
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上学期第一次月考化学试卷(解析版) 题型:填空题
O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为____________,原子个数比为____________。
(2)等温等压下,等体积的O2和O3所含分子个数比为____________,原子个数比为____________,质量比为_________。
(3)配制100 mL 1 mol·L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84 g·mL-1,质量分数为98%)的体积为____________mL。
(4)现要配制1 mol·L-1 Na2CO3溶液250 mL,求:①需要含结晶水的碳酸钠晶体(Na2CO3·10H2O)_____ _______ g;②需要物质的量浓度为4 mol·L-1的Na2CO3溶液____________ mL;
mL,求:①需要含结晶水的碳酸钠晶体(Na2CO3·10H2O)_____ _______ g;②需要物质的量浓度为4 mol·L-1的Na2CO3溶液____________ mL;
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省邯郸市、永年二中高二上期中化学卷(解析版) 题型:选择题
下列说法正确的是( )
A.对于有气体参与的反应,增大压强,活化分子总数增多,化学反应速率增大
B.对放热反应而言,升高温度,活化分子百分数减少,化学反应速率减小
C.活化分子间发生的碰撞为有效碰撞
D.使用催化剂,活化分子百分数增多,化学反应速率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com