
将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) XC(g)+2D(g),经5分钟后,测得D的浓度为0.5mol/L,CA:CB=3:5,C的平均速率为0.1mol/L.min。求
XC(g)+2D(g),经5分钟后,测得D的浓度为0.5mol/L,CA:CB=3:5,C的平均速率为0.1mol/L.min。求
(1)此时CA=
(2)反应开始前容器中的A、B的物质的量nA=nB=
(3)B的平均反应速率VB=
(4)X=
(5)此时容器内的压强与反应开始时压强的比为 。
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
利用太阳能分解水产生H2,在催化剂作用下H2与CO2反应合成CH3OH,并开发出直接以甲醇为燃料的燃料电池。已知:H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1、
CH3OH(l)+ 3/2O2(g)= CO2 (g)+ 2H2O(l) ΔH=-726.5 kJ·mol-1、
CO(g) +1/2O2(g)= CO2 (g) ΔH=-283.0 kJ·mol-1 请回答下列问题:
⑴ 用太阳能分解18g水,需要消耗的能量为 ▲ kJ。
⑵ 液态CH3OH不完全燃烧生成CO和液态H2O的热化学方程式为 ▲ 。
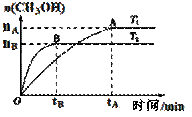 ⑶ CO2合成燃料CH3OH是碳减排的新方向。在容积为2 L的密闭容器中,充2 mol CO2和6 mol H2,由CO2和H2合成甲醇,反应式:CO2(g)+3H2(g)
⑶ CO2合成燃料CH3OH是碳减排的新方向。在容积为2 L的密闭容器中,充2 mol CO2和6 mol H2,由CO2和H2合成甲醇,反应式:CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,
实验结果如下图所示(注:T1、T2均大于300 ℃):
①下列说法正确的是 ▲
A.温度为T2时,从反应开始到平衡,生成甲醇
的平均速率为: v(CH3OH)=nB/tB mol·(L·min)-1
B.T2>T1,T2平衡时,甲醇产量变少,所以该反应为放热反应
C.该反应在T2时的平衡常数比T1时的平衡常数大
D.处于A点的反应体系从T1变到T2,平衡逆向移动
②能判断该反应已达化学反应限度标志的是 ▲ (填字母)。
A.H2的百分含量保持不变 B.容器中CO2 浓度与H2浓度之比为1: 3
C.容器中混合气体的密度保持不变 D.CO2消耗速率与CH3OH生成速率相等
⑷科学家致力于CO2的“组合转化”技术研究,如将CO2和H2以体积比1∶4比例混合通入反应器,适当条件下,反应可获得一种能源。完成以下化学方程式,就能知道该种能源。
CO2+4H2  2H2O + ▲ 。
2H2O + ▲ 。
⑸ 在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,总反应式为:2CH3OH + 3O2=2CO2+4H2O,则正极的反应式为 ▲ ;负极的反应式为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
恒温下,反应aX(g)  bY(g) + cZ(g),达到平衡状态。若把容器的体积压缩到原来的
bY(g) + cZ(g),达到平衡状态。若把容器的体积压缩到原来的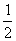 ,达到平衡状态时,X的物质的量浓度从0.1mol/L增大到0.19mol/L。下列判断正确的是( )
,达到平衡状态时,X的物质的量浓度从0.1mol/L增大到0.19mol/L。下列判断正确的是( )
A.a>b+c B.a=b+c C.a<b+c D.a=b=c
查看答案和解析>>
科目:高中化学 来源: 题型:
在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是
2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是
A.x=1 B.B的转化率为20%
C.平衡时A的浓度为1.50 mol·L-1
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒容密闭容器中发生反应2SO2+O2 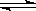 2 SO3,当其他条件不变时,只改变一个条件,将生成SO3的反应速率的变化填入下表格里(填“增大”、“减小”或“不变”)。
2 SO3,当其他条件不变时,只改变一个条件,将生成SO3的反应速率的变化填入下表格里(填“增大”、“减小”或“不变”)。
| 编号 | 改变的条件 | 生成的SO3的速率 |
| (1) | 升高温度 | |
| (2) | 充入一定量N2 | |
| (3) | 减少SO3的浓度 | |
| (4) | 使用催化剂 | |
| (5) | 压缩体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将15.6 g Na2O2和5.4 g Al同时放入一定量的水中,充分反应后得到200 mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变,则下列说法正确的是( )
A.标准状况下,反应过程中得到7.84 L的气体
B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
C.最终得到7.8 g的沉淀
D.最终得到的溶液中c(Na+)=1.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
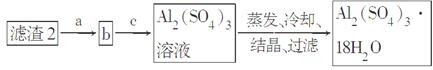
由某金属的混合物(含65%Cu、25%Al、8%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线设计如下:

已知物质开始沉淀和沉淀完全时pH如下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 沉淀开始时pH | 2.7 | 4.1 | 8.3 |
| 沉淀完全时pH | 3.7 | 5.4 | 9.8 |
请回答下列问题:
(1)过滤操作用到的玻璃仪器有________。
(2)第①步Al与足量酸反应的离子方程式为___________________________,
得到滤渣1的主要成分为________。
(3)第②步用NaOH调节溶液pH的范围为________。
(4)由第③步得到CuSO4·5H2O晶体的步骤是将滤液2________、________、过滤、洗涤、干燥。
(5)现有洗涤后的滤渣2制取Al2(SO4)3·18H2O,请将a、b、c补充完整。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1.505×1023个X气体分子的质量为8 g,则X气体的摩尔质量是( )
A.16 g B.32 g
C.64 g/mol D.32 g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB===(NH3通过如下反应制得:3CH4+2HB===NH)3+6H2O===3CO2+6H3BNH3。对合成A反应方程式的讨论中不正确的是( )
A.反应前后碳原子的杂化类型不变
B.键角的大小关系:CO2>CH4>H2O
C.第一电离能大小关系:N>O>C>B>H
D.生成物H3BNH3中存在配位键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com