
��1������agij����AB2������Ħ������ΪMg·mol-1���������ӵ�������NA��ʾ������������ʵ���Ϊ_____mol������������ԭ������Ϊ ���� �������ڱ�״���µ����Ϊ____________L��������һ�����ӵ�����Ϊ g��
�������ڱ�״���µ����Ϊ____________L��������һ�����ӵ�����Ϊ g��
��2��805g Na2SO4·10H2O��������Na+�����ʵ����� ��SO42—�����ʵ����� ������H2O���ӵ���Ŀ�� ����
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
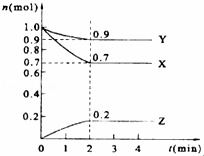
ij�¶�ʱ����2L���ܱ������У�X��Y��Z������������ʵ�����ʱ��ı仯������ͼ��ʾ��
��1����ͼ���������ݽ��з������÷�Ӧ�Ļ�ѧ����ʽΪ����
��2����Ӧ�ӿ�ʼ��2����ĩ����Z��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ������
��3��ԭ���������ƽ��������������ʵ���֮�ȣ�д��������ȣ���ͬ����nʼ��nƽ=��10����
��4���ﵽƽ��ʱ��X��Y��ת����֮�ȣ�����X��������Y��=������
��5��ƽ��ʱ��Z���������Ϊ������������λ��Ч���֣���
��6����Ӧ�ﵽƽ������д�ʩ�ܼӿ컯ѧ��Ӧ���ʵ�����������ţ���ѡ����ѡ�֣���
A������Ӧ���Ũ�� B�������¶� C��ʹ��������
��7������������˵��������Ӧ�ﵽƽ��״̬��������������ţ���ѡ����ѡ�֣���
A��X��Y��Z�����ʵ���֮��Ϊ3��1��2
B����������ѹǿ����ʱ��ı仯���仯
C����λʱ����ÿ����3mol X��ͬʱ����2mol Z
D��������������������ʱ��ı仯���仯
E���������������ʵ�������ʱ��ı仯���䣮
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Ӧ4NH3��g��+5O2��g��⇌4NO��g��+6H2O��g����5L�ܱ������н��У�����Ӻ�NO�����ʵ���������0.3mol�����ʾ�˷�Ӧ��������ȷ���ǣ�������
| �� | A�� | v��O2��=0.01mol•��L•s��﹣1 | B�� | v��NO��=0.008mol•��L•s��﹣1 |
| �� | C�� | v��H2O��=0.003mol•��L•s��﹣1 | D�� | v��NH3��=0.02mol•��L•s��﹣1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NA��ʾ�����ӵ�����������������ȷ���� �� ��
A�����³�ѹ��,1.06g Na2 CO3���е�Na+������ĿΪ0.02 NA
CO3���е�Na+������ĿΪ0.02 NA
B�����³�ѹ�£�2NA ��CO2����ռ�е����Ϊ44.8L
C����״ ���£�22.4LH2O���еķ�����Ϊ NA
���£�22.4LH2O���еķ�����Ϊ NA
D�����ʵ���Ũ��Ϊ0 .5mol/L��MgCl2��Һ�У�����Cl- ����Ϊ NA
.5mol/L��MgCl2��Һ�У�����Cl- ����Ϊ NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ܹ���������BaCl2 �� NaCl �� Na2CO3�������ʵ��Լ��� �� ��
A��ϡ���� B��AgNO3��Һ C��ϡ���� D��ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����������X��Һ�ֱ�����ĸ�ʢ��10 mL 2 mol��L��1������ձ��У�����ˮϡ�͵�50 mL����ʱ��X�����Ỻ���ؽ��з�Ӧ�����з�Ӧ������(����)
A��10�� 20 mL 3 mol��L��1��X��Һ
B��20�� 30 mL 2 mol��L��1��X��Һ
C��20�� 10 mL 4 mol��L��1��X��Һ
D��10�� 10 mL 2 mol��L��1��X��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ�������£����з�Ӧ��ˮ���������淴Ӧʱ��ı仯���Ʒ�����ͼ����(����)

A��CO2(g)��2NH3(g)CO(NH2)2(s)��H2O(g)
��H<0
B��CO2(g)��H2(g)CO(g)��H2O(g)����H>0
C��CH3CH2OH(g)CH2===CH2(g)��H2O(g)����H>0
D��2C6H5CH2CH3(g)��O2(g)2C6H5CH===CH2(g)��2H2O(g)����H<0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��C+CO2⇌2CO﹣Q1����Ӧ����v1��N2+3H2⇌2NH3+Q2��Ӧ����v2������������Ӧ�����¶�����ʱ��v1��v2�ı仯���Ϊ��������
| �� | A�� | ͬʱ���� | B�� | ͬʱ��С |
| �� | C�� | v1����v2��С | D�� | v1��С��v2���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪X��Y��Z��W���ֶ�����Ԫ�ص�ԭ������������������X��Y��Z��W���γɵij��������10e��18e���ڳ����¾�Ϊ��̬����Ԫ�����ڱ���Z��W���ڣ�Y������������ˮ���������⻯�ﷴӦ�����Σ���Y�ĺ˵������W��������������ͬ��
��1��Z���ӵĽṹʾ��ͼ��������
��2��X��Y��Z�����һ�ֻ����ԭ�Ӹ�����Ϊ4��1��1���û�����Ļ�ѧʽ�����������к��еĻ�ѧ����������
��3��X��Y���γɵķ��ӵĵ���ʽΪ����������ͬ��������Ԫ�ص��⻯��е�ߵ�ԭ����������
��4�������һ����ʵ�飬˵��Z��W����Ԫ�طǽ����Ե�ǿ����д��ʵ�鷽��������������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com