
| A. | X的气态氢化物的稳定性比甲烷强 | B. | X的最高价氧化物是XO2 | ||
| C. | X应为非金属元素 | D. | X的最高价氧化物的水化物是强酸 |
分析 根据电子排布规律写出该原子原子结构示意图,根据电子层数判断周期数,根据价电子判断所属族数,根据在周期表中的位置判断判断其化合物的性质.
解答 解:该原子的原子结构示意图为: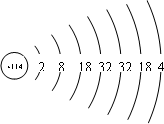 ,最外层有4个电子,属于第IVA族元素,在铅元素下方,金属性比铅强,
,最外层有4个电子,属于第IVA族元素,在铅元素下方,金属性比铅强,
A.同主族从上到下,氢化物的稳定性减弱,则X的气态氢化物的稳定性比甲烷弱,故A错误;
B.X元素的原子最外层有4个电子,则最高价氧化物是XO2,故B正确;
C.属于第IVA族元素,在铅元素下方,金属性比铅强,属于金属元素,故C错误;
D.X在铅元素下方,金属性比铅强,属于金属元素,则X的最高价氧化物的水化物显碱性,故D错误.
故选B.
点评 本题考查根据原子结构示意图、原子结构和性质,侧重于同主族元素性质的变化规律的考查,注意判断元素所属周期和族,比较容易.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 2-甲基-1-丁烯 | B. | 2-甲基-2-丁烯 | ||
| C. | 3-甲基-1-丁炔 | D. | 3,3-二甲基-1-丁炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 实验室用图示装置制取乙酸乙酯.
实验室用图示装置制取乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热91.5 kJ | B. | 放热183 kJ | C. | 吸热183 kJ | D. | 吸热91.5 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Te与H2的反应比S与H2反应困难 | B. | TeO3对应的水化物是一种酸 | ||
| C. | H2Te的还原性比H2S弱 | D. | 有-2、+4、+6三种化合价 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
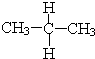 与
与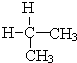 ⑦CH3CH3与
⑦CH3CH3与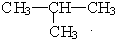
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、Br-、CrO42- | B. | CrO42-、Br-、Cl- | C. | Br-、Cl-、CrO42- | D. | Br-、CrO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 中国全运会期间,在济南市等主要街道上,出现了一座座拔地而起的立体花坛,4000万盆、上百种鲜花扮靓了济南街头.大量盆栽鲜花因施用了S-诱抗素制剂,得以保证鲜花盛开,S-诱抗素的分子结构如右图,下列关于该分子的说法正确的是( )
中国全运会期间,在济南市等主要街道上,出现了一座座拔地而起的立体花坛,4000万盆、上百种鲜花扮靓了济南街头.大量盆栽鲜花因施用了S-诱抗素制剂,得以保证鲜花盛开,S-诱抗素的分子结构如右图,下列关于该分子的说法正确的是( )| A. | 1mol该物质与足量的NaOH溶液反应最多消耗2mol NaOH | |
| B. | 该物质在Cu作催化剂条件下能被催化氧化 | |
| C. | 该物质能发生氧化、还原、取代反应 | |
| D. | 分别与足量的Na、NaHCO3 反应生成的气体在相同状况下体积比为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com