
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.1.2 g金刚石中含有的碳碳单键数为0.4NA
B.4.4 g二氧化碳中含有的共用电子对数为0.4NA
C.常温时11.2 L乙烯在氧气中完全燃烧转移的电子数为6.0NA
D.常温下0.1 mol·L-1硝酸铵溶液中,NH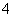 和H+总数一定大于0.1NA
和H+总数一定大于0.1NA
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
下列说法中,正确的是
A.凡是放热反应都是自发反应
B.凡是熵增大的反应都是自发反应
C.要判断反应进行的方向,必须综合考虑体系的焓变和熵变
D.过程的自发性不仅能用于判断过程的方向,还能确定过程是否一定能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关认识正确的是( )
A.各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7
B.各电子层的能级都是从s能级开始至f能级结束
C.各电子层含有的能级数为n-1
D.各电子层含有的电子数为2n2
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室有下列试剂,其中必须用带橡胶塞的试剂瓶保存的是( )
①NaOH溶液 ②水玻璃 ③Na2S溶液 ④Na2CO3溶液
⑤NH4Cl溶液 ⑥澄清石灰水 ⑦浓HNO3 ⑧浓H2SO4
A.①⑥ B.①②③④⑥
C.①②③⑥⑦⑧ D.⑤⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)碳酸钾溶液蒸干得到的固体物质是
________________________________________________________________________,
原因是_________________________________________________________________
________________________________________________________________________。
(2)KAl(SO4)2溶液蒸干得到的固体物质是
原因是__________________________________________________________________
________________________________________________________________________。
(3)碳酸氢钡溶液蒸干得到的固体物质是
________________________________________________________________________,
原因是_________________________________________________________________。
(4)亚硫酸钠溶液蒸干得到的固体物质是
________________________________________________________________________,
原因是__________________________________________________________________。
(5)氯化铝溶液蒸干得到的固体物质是
________________________________________________________________________,
原因是________________________________________________________________。
(6)盐酸与硫酸各1 mol·L-1的混合酸10 mL,加热浓缩至1 mL,最后的溶液为______________,原因是______________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,1.12 L CCl4含有C—Cl键数目为0.2NA
B.标准状况下,2.24 L氯气中含有的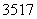 Cl数目一定为0.2NA
Cl数目一定为0.2NA
C.常温常压下,4.4 g CO2与N2O混合气体中含有的原子总数为0.3NA
D.80 mL 10 mol·L-1盐酸与足量MnO2加热反应,产生Cl2分子数小于0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项比较中,正确的是
A.原子核外电子数:H>O>Al B.元素非金属性:F>Cl>Br
C.热稳定性:PH3>H2S>HCl D.碱性:LiOH>NaOH>KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
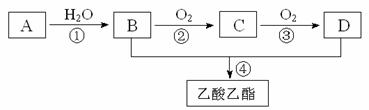
回答下列问题:
(1)写出A的电子式 ;
(2)B、D分子中的官能团名称分别是 、 ;
(3)写出下列反应的反应类型:① ④ ;
(4)写出A→B反应的化学方程式:
A→B ;
(5)已知0.1mol液态的B完全燃烧生成液态水时放出136.68kJ热量,该反应的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应:CO+H2O(g)
 CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是( )
A.0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2
B.1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2
C.0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2
D.0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com