
����Ŀ����ҵ�ϴӷ�Ǧ���ص�Ǧ�����Ǧ�Ĺ����У�����̼������Һ��Ǧ�ࣨ��Ҫ�ɷ�ΪPbSO4��������Ӧ��PbSO4��s��+CO ![]() ��aq��PbCO3��s��+SO
��aq��PbCO3��s��+SO ![]() ��aq����Ksp ��PbCO3��=1.5��10��13 �� Ksp ��PbSO4��=1.8��10��8ij��������PbSO4Ϊԭ��ģ��ù��̣�̽��������Ӧ��ʵ���������������ijɷ֣�
��aq����Ksp ��PbCO3��=1.5��10��13 �� Ksp ��PbSO4��=1.8��10��8ij��������PbSO4Ϊԭ��ģ��ù��̣�̽��������Ӧ��ʵ���������������ijɷ֣�
��1������������Ӧ��ƽ�ⳣ����K= ��
��2����������NaHCO3��ҺҲ��ʵ�ָ�ת����д�����ӷ���ʽ
��3���������ף�������Ӧ���������ɼ�ʽ̼��Ǧ[2PbCO3Pb��OH��2]������PbCO3���ȶ��ֽ��PbO���ÿ�����Թ�����������PbSO4���ijɷ�������¼��裬����һ��ȫ��Ϊ2PbCO3Pb��OH��2��
�������ȫ��ΪPbCO3��
��������2PbCO3Pb��OH��2 ��PbCO3�Ļ����
Ϊ��֤����һ�Ƿ��������������������о���
ʵ�鲽�� | ʵ������ͽ��� |
ȡһ������Ʒ��ָ��Ȼ����Ʒ���ȷֽ⣬����������������ͨ��ʢ����ˮ����ͭ�ĸ���ܺ�ʢ�г���ʯ��ˮ��ϴ��ƿ�� | ��ˮ����ͭ����ɫ������ʯ��ˮ����� |
�����Ƿ�ͬ���ͬѧ�Ľ��ۣ����������� ��
�������ͬ�⣬������Ľ���� ��
���𰸡�
��1��1.2��105
��2��2HCO ![]() +PbSO4=SO
+PbSO4=SO ![]() +PbCO3+H2O+CO2��
+PbCO3+H2O+CO2��
��3����ͬ�⣮��Ϊ����������ͬ����������������ͨ��������Ũ����ͳ���ʯ��ˮ�����ֱ�������ص�������ͨ������ȷ��HԪ�غ�CԪ�ص����ʵ���֮�ȣ���n��C����n��H��=1��1����Ϊ����һ����n��c����n��H����1��1����Ϊ������
���������⣺��1��ƽ�ⳣ��K= ![]() =
= ![]() =
= ![]() =1.2��105 �� ���Դ��ǣ�1.2��105����2��HCO3���ɵ����CO32�� �� ��PbSO4��Ӧ����PbCO3 �� ��Ӧ�����ӷ���ʽΪ2HCO3��+PbSO4=SO42��+PbCO3+H2O+CO2�������Դ��ǣ�2HCO3��+PbSO4=SO42��+PbCO3+H2O+CO2������3���ٽ���Ʒ���ȣ���ˮ����ͭ����ɫ������ʯ��ˮ����ǣ���˵������ˮ�Ͷ�����̼��������˵����Ʒȫ����2PbCO3Pb��OH��2 �� Ҳ����Ϊ2PbCO3Pb��OH��2 ��PbCO3�Ļ�����2PbCO3Pb��OH��2 ��PbCO3�Ļ����ֱ�Ҳ��ʹ��ˮ����ͭ����ɫ������ʯ��ˮ����ǣ����Դ��ǣ���ͬ�⣮��Ϊ����������ͬ����������Ϊ2PbCO3Pb��OH��2 �� ������n��C����n��H��=1��1���ɽ���������ͨ��������Ũ����ͳ���ʯ��ˮ�����ֱ�������ص�������ͨ������ȷ��HԪ�غ�CԪ�ص����ʵ���֮�ȣ���n��C����n��H��=1��1����Ϊ����һ����n��c����n��H����1��1����Ϊ�����������Դ��ǣ�����������ͨ��������Ũ����ͳ���ʯ��ˮ�����ֱ�������ص�������ͨ������ȷ��HԪ�غ�CԪ�ص����ʵ���֮�ȣ���n��C����n��H��=1��1����Ϊ����һ����n��c����n��H����1��1����Ϊ��������
=1.2��105 �� ���Դ��ǣ�1.2��105����2��HCO3���ɵ����CO32�� �� ��PbSO4��Ӧ����PbCO3 �� ��Ӧ�����ӷ���ʽΪ2HCO3��+PbSO4=SO42��+PbCO3+H2O+CO2�������Դ��ǣ�2HCO3��+PbSO4=SO42��+PbCO3+H2O+CO2������3���ٽ���Ʒ���ȣ���ˮ����ͭ����ɫ������ʯ��ˮ����ǣ���˵������ˮ�Ͷ�����̼��������˵����Ʒȫ����2PbCO3Pb��OH��2 �� Ҳ����Ϊ2PbCO3Pb��OH��2 ��PbCO3�Ļ�����2PbCO3Pb��OH��2 ��PbCO3�Ļ����ֱ�Ҳ��ʹ��ˮ����ͭ����ɫ������ʯ��ˮ����ǣ����Դ��ǣ���ͬ�⣮��Ϊ����������ͬ����������Ϊ2PbCO3Pb��OH��2 �� ������n��C����n��H��=1��1���ɽ���������ͨ��������Ũ����ͳ���ʯ��ˮ�����ֱ�������ص�������ͨ������ȷ��HԪ�غ�CԪ�ص����ʵ���֮�ȣ���n��C����n��H��=1��1����Ϊ����һ����n��c����n��H����1��1����Ϊ�����������Դ��ǣ�����������ͨ��������Ũ����ͳ���ʯ��ˮ�����ֱ�������ص�������ͨ������ȷ��HԪ�غ�CԪ�ص����ʵ���֮�ȣ���n��C����n��H��=1��1����Ϊ����һ����n��c����n��H����1��1����Ϊ��������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����������Һ���ܴ���������ǣ� ��
A. Na����Al3����Cl����SO42-B. Mg2����Cl����NO3-��OH��
C. Ba2����Na����CO32-��NO3-D. H����SO42-��NO3-��OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ըɺ���Ϊԭ����ȡ�ⵥ�ʺ��Ȼ��صĹ�����Ҫ�����������������գ�
��1������һ�����ոɺ�����ʹ��һ�������ˮ���ݡ����ˣ��Ƶ�ԭ��Һ�������Ȼ��ص����ʣ�ʵ�������պ���Ӧ��������д�������ƣ��м��ȣ�ѡ����ˮ��������ˮ���ݺ����ҵ�Ŀ���� ��
��2���������ԭ��Һ���ᾧ���˷�����Ȼ��غ�����Һ��ͨ������������I�� �� �Ƶø�����Һ��ʵ����ģ���������̵�ʵ��װ����ͼ��ʾ��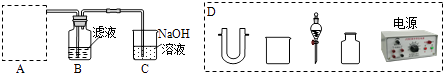
װ����A����������ȡ������ʵ������ȡ����ͨ�������ַ�����һ����ǿ����������������������Cl�������ǵ�ⷨ������ͼD�е�������֧�����������ܡ����ߡ�ʯī������Ƥ�����⣩����ʵ�ֵķ�Ӧ����ѡ���ţ���
a��2NaCl��s��+MnO2+2H2SO4��Ũ�� ![]() MnSO4+Cl2��+Na2SO4+2H2O
MnSO4+Cl2��+Na2SO4+2H2O
b��2KMnO4+16HCl��Ũ����2MnCl2+2KCl+5Cl2��+8H2O
c��2NaCl+2H2O ![]() 2NaOH+Cl2��+H2��
2NaOH+Cl2��+H2��
d��4HCl��Ũ��+MnO2 ![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
���ƿB�з�����Ӧ�����ӷ���ʽ�� �� װ��C��NaOH�������� ��
��3����������ȡ100mL B�и�����Һ�����������̷���ⵥ�ʣ�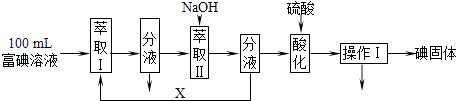
��ȡ����ữ���̷����ķ�Ӧ�ֱ��ǣ�
3I2+6OH����5I��+IO3��+3H2O��
5I��+IO3��+6H+��3I2+3H2O��
��ȡ��XӦѡ����ѡ���ţ���
a��100mL��b��10mL�Ҵ�c��10mLCCl4d��10mL��ϩ
ʵ���ҽ�����ȡ������������ �� ������������� ��
��4���������KCl��Ʒ�г���������NaCl��K2CO3�����ʣ����ʵ���ó������ⶨ�Ȼ�����Ʒ��K2CO3��������������Ҫ�õ��Ļ�ѧ�Լ�������д��ѧʽ����
��Ҫ�ⶨ���������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��л�������ᴿ�ķ�����ȷ���� �� ��
A.�屽�л����壬����KI��Һ������������ȡ��I2
B.�����л�����ϩ��ͨ��������һ�������·�Ӧ��ʹ��ϩת��Ϊ����
C.��ȥ�Ҵ��е���ˮ�ɼ�������ƣ�ʹ����ȫ��Ӧ
D.��ϩ�л���CO2��SO2 �� ����ͨ��ʢ��NaOH��Һ��ϴ��ƿ���ٸ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ����ȷ���� ( )
A. ����ͨ��ϡ�����У�NH3��H+��NH4+
B. ������̼ͨ��̼������Һ�У�CO2��CO![]() ��H2O��2HCO3��
��H2O��2HCO3��
C. ������������Ũ���ᷴӦ��Fe3O4��8H��===Fe2����2Fe3����4H2O
D. ����ʯ��ˮ�������С�մ���Һ��Ӧ��Ca2����OH����HCO![]() ===CaCO3����H2O
===CaCO3����H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ȿ�����Ũ�������ֿ����ù����ʯ�Ҹ�����ǣ�������
A.SO2
B.NH3
C.Cl2
D.H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25�棬101kPa�£�̼������������������ǵ�ȼ����������393.5kJ/mol��285.8kJ/mol��890.3kJ/mol��2800kJ/mol���������Ȼ�ѧ����ʽ��ȷ���ǣ� ��
A.C��s��+ ![]() O2��g��=CO��g������H=��393.5 kJ/mol
O2��g��=CO��g������H=��393.5 kJ/mol
B.2H2��g��+O2��g��=2H2O��g������H=+571.6 kJ/mol
C.CH4��g��+2O2��g��=CO2��g��+2H2O��l������H=��890.3 kJ
D.![]() C6H12O6��s��+3O2��g��=3CO2��g��+3H2O��l������H=��1400 kJ/mol
C6H12O6��s��+3O2��g��=3CO2��g��+3H2O��l������H=��1400 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ��Ϊԭ�Ͽ��Ժϳɶ��ָ߾���ĺϳ�·�����£�
��֪��ϩ����X2��һ���������ܷ���ȡ�������ܷ���˫ϩ�ϳ��� ![]() ��
��
��ش��������⣺
��1��X�к��еĹ�����Ϊ��
��2��Y��Z�Ļ�ѧ����ʽΪ��
��3���߾���E�Ľṹ��ʽΪ������A��һ��ͬ���칹�壬����ʵ��ת���� ![]() ��������Ϊ��
����������
��4���� ![]() ���Ժϳ�
���Ժϳ� ![]() �����ϳ�·�ߵ�˳���漰��Ӧ�ķ�Ӧ�����У� ��
�����ϳ�·�ߵ�˳���漰��Ӧ�ķ�Ӧ�����У� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ����������⣺
��1�������ؽṹ��ͼ 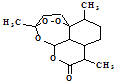 ���й�������ȷ������ѡ����ţ��� a����ѧʽΪC15H21O5 b��������NaOH��Һ��Ӧ
���й�������ȷ������ѡ����ţ��� a����ѧʽΪC15H21O5 b��������NaOH��Һ��Ӧ
c��������ˮ d�����й��������н�ǿ������
��2����������Ϊԭ�ϳ��������岽�ϳɿɵõ������أ����е�2��Ϊ��ԭ��Ӧ�� 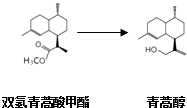 �����¼��ɷ�Ӧ���Է��ȣ���ԭ��ΪLiAlH4 �� ������ʵ����ʣ�
�����¼��ɷ�Ӧ���Է��ȣ���ԭ��ΪLiAlH4 �� ������ʵ����ʣ�
���� | ���� |
˫�������������C16H28O2�� | ���壬������ˮ���������л��ܼ��� |
���ﴼ��C15H28O�� | ���壬������ˮ���������л��ܼ��� |
���� | ��ɫҺ�壬����ˮ���ܶ�0.71g/cm3���е㣺34.6�森 |
�⻯��� | ���壬�������ѣ���ˮ��Ӧ��LiAlH4+4H2O��Al��OH��3��+LiOH+4H2���ɽ�һ��������ԭ�ɶ����Ӵ����������ɴ�������ﮣ�����������﮿������ᷴӦ���������Ρ���κ���Ӧ�Ĵ����� |
ijѧϰС����ʵ������˫�������������ȡ���ﴼ��
�ٷ�Ӧ��ʹ�ù������⻯��ﮣ������� �� Ϊʹ��Ӧ����Һ״̬�½��У���������Ϊ�ܼ�������ˮ�������� ��
�������ʵ�����Ʊ�װ�ã�������ͼ����
��3���÷�Ӧ�л����ת����ԼΪ96%������������Һ�к��д�ﮡ�������˫��������������⻯��ﮣ��ӷ�Ӧ���������ȡ���ﴼ�ķ����ǣ��ټ����Һ��
�ڴ����Ѳ���ȡ���ﴼ���ж��ַ����������Ƕ��ַ�����
����һ�������ᾧ�� �������������������壮
a����2�����������������Ӧ�в���Һ��ԭ���� ��
b�������2���������бȽ� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com