
已知在某密闭容器中进行的反应a A (g) ![]() b B (g)+ c C (g),(其中a、 b、c分别为方程式中的物质计量数),某物理量Y随时间(t)变化的情况如右图所示(X1、X2表示不同温度或压强),请回答下列问题:
b B (g)+ c C (g),(其中a、 b、c分别为方程式中的物质计量数),某物理量Y随时间(t)变化的情况如右图所示(X1、X2表示不同温度或压强),请回答下列问题:

(1)当X1、X2分别表示不同的温度状况时,Y可代表生成物C在平衡时混合物中的质量分数, 则该反应的正反应是 反应(填“放热”或“吸热”);
(2)当X1、X2分别表示不同的压强状况时,Y可代表反应物A的转化率,则X1 X2(选填“>”或“<”或“=”);a、 b 、c三者之间的关系为 a (b+c)(填“>”或“<”或“=”)
(3)将 4mol A、3mol B、2mol C充入该反应容器中,在温度为T,压强为P的条件下达平衡后,测得A、B、C的物质的量分别是2mol A、5mol B、3mol C,则a、b、c的最简整数比为 ;此时A的转化率为 。若将最初充入该反应容器中的各物质的物质的量变为5mol A、2mol B、1.5mol C,也在温度为T,压强为P的条件下建立平衡,此时容器中的C在混合气体中的体积分数为30%,则此时A的转化率为 。
(4)将 4mol A、3mol B、2mol C充入该反应容器中并达平衡,下列措施能提高物质B在平衡混合气体中体积分数的是 (填写序号)
①增加B的物质的量 ②加入合适的催化剂
③增加A的物质的量 ④降低温度
科目:高中化学 来源:2007-2008年北京四中高三年级第一学期期中测验、化学试卷 题型:058
下图是某化学小组在实验室研究二氧化硫催化氧化并制取三氧化硫晶体的装置.
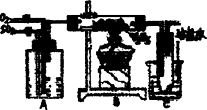
(1)检查装置的气密性,加入药品后,进行实验.A装置可控制SO2和O2的进气量,理论上A中两导管(口径大小相同)冒出气泡的速率应是________,实验时中两导管冒出气泡的速率大致相同,其原因是_________________.
A处装的药品是________.C中的实验现象是________,从C端排出的尾气的成分是________,为减轻实验对环境污染,请你设计尾气处装置,用简要文字说明所加试剂及操作顺序________.
(2)已知6.4克二氧化硫氧化成气态三氧化硫放出的热量为9.83 kJ,该热化学方程式为________,若将2 mol SO2和1 mol O2充入一密闭容器反应,SO2的转化率为9%,此时Δ=________(上述反应的条件相同).
(3)若将从500℃变为400℃时,v(正)________,(填“增大”、“不变”或“减小”,下同),c(SO3):c(SO2)的比值________,SO2转化率________.
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是某化学小组在实验室研究二氧化硫催化氧化并制取三氧化硫晶体的装置。
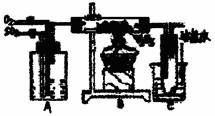
(1)检查装置的气密性,加入药品后,进行实验。A装置可控制SO2和O2的进气量,理论上A中两导管(口径大小相同)冒出气泡的速率应是 ,实验时中两导管冒出气泡的速率大致相同,其原因是 。
A处装的药品是 。C中的实验现象是 ,从C端排出的尾气的成分是 ,为减轻实验对环境污染,请你设计尾气处装置,用简要文字说明所加试剂及操作顺序 。
(2)已知6.4克二氧化硫氧化成气态三氧化硫放出的热量为9.83kJ,该热化学方程式为 ,若将2mol SO2和1 mol O2充入一密闭容器反应,SO2的转化率为9%,此时△= (上述反应的条件相同)。
(3)若将温度从500℃变为400℃时,v(正) ,(填“增大”、“不变”或“减小”,下同),c(SO3):c(SO2)的比值 ,SO2转化率 。
查看答案和解析>>
科目:高中化学 来源:2011-2012年甘肃天水一中高一下学期第一学段考试文科化学试卷(解析版) 题型:计算题
在一定条件下,在1 L密闭容器中发生反应3A(g)+B(g) 2C(g),开始时加入4 mol A、6 mol B,在2 min末时测得C的物质的量是2 mol。
2C(g),开始时加入4 mol A、6 mol B,在2 min末时测得C的物质的量是2 mol。
(1)用A的浓度变化表示反应的平均速率为v(A)=___________;
(2)2 min末时,B的浓度为c(B)=__________;
【解析】考查有关化学反应速率的计算。在有关反应速率的计算时一般采用三段式进行计算,即根据反应式分别列出起始量、转化量和平衡量(或某时刻的量),然后在根据已知条件进行列式计算。即:
3A(g) + B(g) 2C(g)
2C(g)
起始量(mol) 4 6 0
转化量(mol) 3 1 2
2min(mol) 1 5 2
因为反应速率通常用单位时间内浓度的变化量来表示
所以用A的浓度变化表示反应的平均速率为
2 min末时,B的浓度为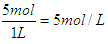
查看答案和解析>>
科目:高中化学 来源:山东省模拟题 题型:填空题
 H2(g) +CO2
H2(g) +CO2
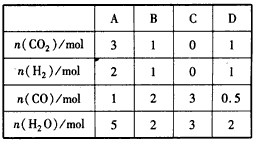
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,在1 L密闭容器中发生反应3A(g)+B(g)2C(g),开始时加入4 mol A、6 mol B,在2 min末时测得C的物质的量是2 mol。
(1)用A的浓度变化表示反应的平均速率为v(A)=___________;
(2)2 min末时,B的浓度为c(B)=__________;
【解析】考查有关化学反应速率的计算。在有关反应速率的计算时一般采用三段式进行计算,即根据反应式分别列出起始量、转化量和平衡量(或某时刻的量),然后在根据已知条件进行列式计算。即:
3A(g) + B(g)2C(g)
起始量(mol) 4 6 0
转化量(mol) 3 1 2
2min(mol) 1 5 2
因为反应速率通常用单位时间内浓度的变化量来表示
所以用A的浓度变化表示反应的平均速率为
2 min末时,B的浓度为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com