
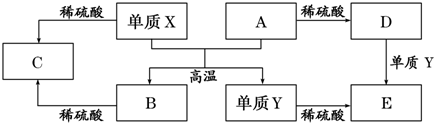
| A. | 单质Y在一定条件下能与水发生置换反应 | |
| B. | 向D溶液中滴加KSCN溶液,产生血红色沉淀 | |
| C. | X与A反应的化学方程式是 Al2O3+2Fe$\frac{\underline{\;高温\;}}{\;}$Fe2O3+2Al | |
| D. | 由于氧化物A和B均能与酸反应所以均是碱性氧化物 |
分析 依据转化关系分析,A+X=B+Y是置换反应,单质XY都和稀硫酸反应,说明是金属单质,AB是氧化物和硫酸反应,其中A和硫酸反应生成的D和单质Y反应生成E,说明A中元素化合价是变价,综合分析判断,置换反应是铝热反应的置换反应,所以判断X为Al;Y为Fe;A为Fe2O3;B为Al2O3;C为Al2(SO4)3;D为Fe2(SO4)3;E为FeSO4;依据判断结果分析选项问题;
解答 解:依据转化关系分析,A+X=B+Y是置换反应,单质XY都和稀硫酸反应,说明是金属单质,AB是氧化物和硫酸反应,其中A和硫酸反应生成的D和单质Y反应生成E,说明A中元素化合价是变价,综合分析判断,置换反应是铝热反应的置换反应,所以判断X为Al;Y为Fe;A为Fe2O3;B为Al2O3;C为Al2(SO4)3;D为Fe2(SO4)3;E为FeSO4;
A、单质Y为Fe,在高温条件下能与水蒸汽发生置换反应,生成四氧化三铁和氢气,故A正确;
B、向D溶液中滴加KSCN溶液生成的不是沉淀:Fe3++3SCN-=Fe(SCN)3,故B错误;
C、x与A反应的化学方程式是:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,故C错误;
D、由于化合物B为Al2O3既能与酸反应,又能与碱反应,所以是两性化合物,C为Al2(SO4)3是盐不具有两性,故D错误;
故选A.
点评 本题考查了物质转化关系的推断,物质性质的应用,反应特征是推断,熟练掌握物质转化关系和特征性质是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
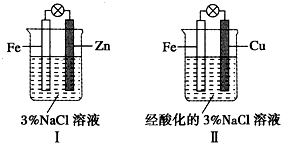
| A. | Ⅰ是验证牺牲阳极的阴极保护法的实验装置 | |
| B. | Ⅰ和Ⅱ中负极反应式均是:Fe-2e-=Fe2+ | |
| C. | Ⅰ和Ⅱ中正极反应式均是:2H++2e-=H2 | |
| D. | Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H8 | B. | CO | C. | H2 | D. | CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
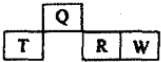 如图是元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法不正确的是( )
如图是元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法不正确的是( )| A. | 气态氢化物的稳定性:W>R | |
| B. | 元素T的最高价氧化物水化物可能是强碱 | |
| C. | Q的原子半径比T小 | |
| D. | W和Q的原子序数相差10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
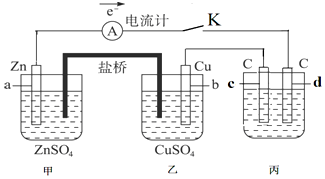
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀锡的铁皮,破损后铁皮反而易被腐蚀 | |
| B. | 纯铁比生铁更易被腐蚀 | |
| C. | 金属的电化腐蚀比化学腐蚀普遍 | |
| D. | 金属腐蚀的本质是M-ne-=Mn+而被损耗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com