
【题目】三草酸合铁酸钾[K3Fe(C2O4)33H2O]是制备负载型活性铁催化剂的主要原料。某化学小组探究用废铁屑(含少量-2价S元素)为原料制备三草酸合铁(Ⅲ)酸钾晶体。具体流程如图:
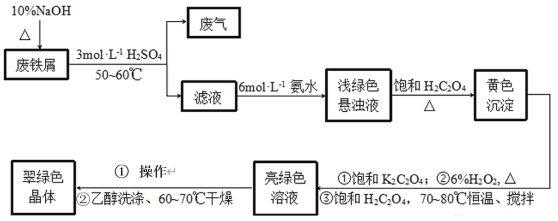
已知:①(NH4)2Fe(SO4)26H2O为蓝绿色晶体,FeC2O4·2H2O为难溶于水的黄色晶体,K3Fe(C2O4)3·3H2O为可溶于水、难溶于乙醇的翠绿色晶体。
②25℃时,[Fe(C2O4)3]3-(aq)+SCN-(aq)![]() [Fe(SCN)]2+(aq)+3C2O
[Fe(SCN)]2+(aq)+3C2O![]() (aq) K=6.31×10-17。
(aq) K=6.31×10-17。
③[Fe(SCN)]2+(aq)为血红色。
回答下列问题:
(1)三草酸合铁酸钾[K3Fe(C2O4)33H2O]中铁的化合价是_____。
(2)废铁屑中加入10%NaOH并加热的目的是__。
(3)为防止污染空气,反应所产生的“废气”可选择__净化处理。(填选项)
A.H2O B.NaOH溶液 C.盐酸 D.CuSO4溶液
(4)写出浅绿色悬浊液中加入饱和H2C2O4生成黄色沉淀的化学方程式:__。
(5)制备过程中加入6%H2O2的目的是__,温度保持70~80℃,采用的合适加热方式是__。
(6)获得翠绿晶体的操作①是___。
(7)用乙醇洗涤晶体的原因是___。
(8)某同学欲检验所制晶体中的Fe(Ⅲ),取少量晶体放入试管中,加蒸馏水使其充分溶解,再向试管中滴入几滴0.1molL-1KSCN溶液。请判断上述实验方案是否可行并说明理由:___。
【答案】+3 去除废铁屑表面的油污 BD (NH4)2Fe(SO4)26H2O+H2C2O4=FeC2O42H2O+(NH4)2SO4+H2SO4+4H2O 将Fe(Ⅱ)氧化成Fe(Ⅲ) 水浴加热 加热浓缩,冷却结晶,过滤 为了除去晶体表面残留的水分且防止晶体溶解损失 否,因为[Fe(C2O4)3]3-转化为[Fe(SCN)]2+反应的平衡常数小于1.0×10-5,观察不到明显现象,所以无法检验
【解析】
废铁屑先用热的NaOH溶液除去表面的油污,然后加入稀硫酸,铁和稀硫酸反应生成硫酸亚铁,-2价S元素遇酸转变为有毒气体H2S,H2S可以用NaOH溶液或CuSO4溶液吸收。得到的硫酸亚铁溶液中加入氨水,生成(NH4)2Fe(SO4)26H2O,再加入饱和H2C2O4,生成难溶于水的黄色晶体FeC2O4·2H2O,过滤后向沉淀中加入饱和K2C2O4,然后加入6%H2O2溶液,使Fe(Ⅱ)被氧化成Fe(Ⅲ),再加入饱和H2C2O4,得到K3Fe(C2O4)3溶液,溶液经蒸发浓缩、冷却结晶,过滤得到K3Fe(C2O4)3·3H2O晶体,用乙醇洗涤,干燥后得到纯净的K3Fe(C2O4)3·3H2O。
(1)三草酸合铁酸钾[K3Fe(C2O4)33H2O]中钾为+1价,碳为+3价,氧为-2价,根据正负化合价代数和为0的原则,可计算出铁的化合价是+3价。
(2)废铁屑长期露置于空气中,表面会有油污,加热时油污可以在碱性环境下彻底水解,所以加入10%NaOH并加热的目的是去除废铁屑表面的油污。
(3)废铁屑中-2价S元素遇酸转变为有毒气体H2S,H2S是酸性气体,能溶于碱溶液,可以用NaOH溶液吸收,H2S也可以和硫酸铜溶液反应生成CuS沉淀,所以也可以用CuSO4溶液吸收,故选BD。
(4)浅绿色悬浊液中有(NH4)2Fe(SO4)26H2O,加入饱和H2C2O4生成黄色沉淀FeC2O4·2H2O,化学方程式为:(NH4)2Fe(SO4)26H2O+H2C2O4=FeC2O42H2O+(NH4)2SO4+H2SO4+4H2O。
(5)黄色沉淀是FeC2O4·2H2O,其中铁是+2价,要制备的K3Fe(C2O4)33H2O中铁是+3价,所以需要将Fe(Ⅱ)氧化成Fe(Ⅲ),所以加入6%H2O2的目的是将Fe(Ⅱ)氧化成Fe(Ⅲ),温度保持70~80℃,采用的合适加热方式是水浴加热。
(6)从K3Fe(C2O4)3溶液中获得K3Fe(C2O4)3·3H2O晶体,需经蒸发浓缩、冷却结晶,过滤。
(7)由于K3Fe(C2O4)3·3H2O难溶于乙醇,所以用乙醇洗涤,既可以除去晶体表面残留的水分,又能防止晶体溶解损失。
(8)根据[Fe(C2O4)3]3-(aq)+SCN-(aq)![]() [Fe(SCN)]2+(aq)+3C2O42- (aq) K=6.31×10-17,因为[Fe(C2O4)3]3-转化为[Fe(SCN)]2+反应的平衡常数小于1.0×10-5,观察不到明显现象,所以无法检验所制晶体中是否含Fe(Ⅲ)。
[Fe(SCN)]2+(aq)+3C2O42- (aq) K=6.31×10-17,因为[Fe(C2O4)3]3-转化为[Fe(SCN)]2+反应的平衡常数小于1.0×10-5,观察不到明显现象,所以无法检验所制晶体中是否含Fe(Ⅲ)。


科目:高中化学 来源: 题型:
【题目】如图所示是碳酸钙(CaCO3)在25 ℃和100 ℃两种情况下,在水中的溶解平衡曲线。下列有关说法正确的是
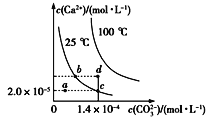
A. CaCO3(s)![]() Ca2+(aq)+ CO32-(aq) ΔH<0
Ca2+(aq)+ CO32-(aq) ΔH<0
B. a、b、c、d四点对应的溶度积Ksp相等
C. 温度不变,蒸发水,可使溶液由a点变到c点
D. 25 ℃时,CaCO3的Ksp=2.8×10-9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一反应体系中有反应物和生成物共5种物质:H2S+HNO3→S+NO+H2O;下列说法中正确的是( )
A.该反应中的还原产物是S
B.若反应过程中转移了0.3 mol 电子,则氧化产物的质量9.6g
C.氧化剂与还原剂的物质的量之比为2∶3
D.反应后溶液的酸性明显增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.在CaF2晶体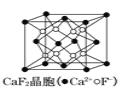 中,Ca2+的配位数是8
中,Ca2+的配位数是8
B.1mol金刚石晶体中,平均含有2molC—C键
C.HF、HCl、HBr、HI的热稳定性从左到右依次减弱
D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新春佳节少不了饮酒,土法酿造葡萄酒(只加糖的纯天然酿酒法)容易出问题,有报道说,喝了自制葡萄酒差点失明。主要原因是发酵过程产生的菌种多达百种,难以控制,而产生对神经有毒的甲醇等物质。科学酿酒须加SO2等辅料。我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。
(1)葡萄酒中添加SO2的作用可能是________。
A.抗氧化 B. 氧化细菌 C.增酸作用 D. 漂白
I.实验方案一
利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如图的实验:

(2)甲同学得出实验结论: 干白葡萄酒中不含SO2或H2SO3。这个结论是否合理?说明理由___________。
Ⅱ.实验方案二
如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
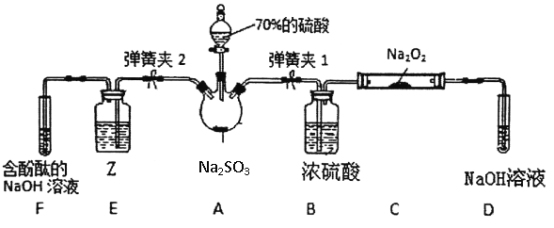
(3)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没瓶中固体,写出A装置反应的化学方程式______,C中每消耗2molNa2O2,则转移电子数___________。
(4)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,为了证明SO2有还原性,并从绿色化学的角度考虑,则Z试剂可以是____,反应的离子反应方程式为____________,现象是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能用勒夏特列原理解释的是
A.使用铁触媒,加快合成氨反应速率
B.过量空气有利于SO2转化为SO3
C.打开汽水瓶盖,即有大量气泡逸出
D.将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100 mL 0.3 mol·L-1 Na2SO4溶液和50 mL 0.2 mol·L-1 Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为( )
A. 0.20 mol·L-1B. 0.25 mol·L-1
C. 0.40 mol·L-1D. 0.50 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g)![]() Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
T/K | 938 | 1 100 |
K | 0.68 | 0.40 |
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量__;充入氦气,混合气体的密度__(填“增大”“减小”或“不变”)。
(2)830℃,反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的平衡常数K=1,在2L恒容反应器中发生上述反应,分别充入3molCO2、2molH2、1molCH3OH、4molH2O(g),反应向__方向进行。(填“正”、“逆”或“不移动”)
CH3OH(g)+H2O(g)的平衡常数K=1,在2L恒容反应器中发生上述反应,分别充入3molCO2、2molH2、1molCH3OH、4molH2O(g),反应向__方向进行。(填“正”、“逆”或“不移动”)
(3)25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | NH3·H2O | H2CO3 | H2SO3 |
电离平衡常数 | 1.7×10-5 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.3×10-2 K2=6.3×10-8 |
①写出CH3COOH的电离方程式____,其电离平衡常数表达式K a=___;
②根据表中数据判断,浓度均为0.01mol·L-1的下列三种物质的溶液中,酸性最强的是___(填编号);将下列各溶液分别稀释100倍,pH变化最小的是___(填编号)。
A.CH3COOH B.H2CO3 C.H2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是( )
A.2-甲基丁烷也称异丁烷
B.C4H9Cl有3种同分异构体
C.正丁烷的4个碳原子可以在同一直线上
D.甲烷、乙烷、丙烷的结构都只有一种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com