
【题目】有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中c(Cl)与c(SO42)之比为( ) 
A.1:1
B.2:3
C.3:2
D.2:1
【答案】B
【解析】解:设氢氧化钠物质的量浓度为1mol/L,首先发生反应Mg2++2OH﹣═Mg(OH)2↓、Al3++3OH﹣═Al(OH)3↓,然后发生反应Al(OH)3+OH﹣═AlO2﹣+2H2O,由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为0.25V,物质的量为0.25Vmol,则n(Al3+)=0.25Vmol,根据离子方程式Al3++3OH﹣═Al(OH)3↓可知,沉淀Al3+消耗的氢氧化钠溶液的物质的量为0.25Vmol×3=0.75Vmol,沉淀Mg2+、Al3+总共消耗氢氧化钠溶液V,计算沉淀Mg2+消耗的氢氧化钠溶液的物质的量为Vmol﹣0.75molV=0.25Vmol,则n(Mg2+)=0.125Vmol,n(Cl﹣)=0.25Vmol;n(Al3+)=0.25Vmol,n(SO42﹣)= ![]() n(Al3+)=
n(Al3+)= ![]() ×0.25Vmol,溶液中c(Cl﹣):c(SO42﹣)=n(Cl﹣):n(SO42﹣)=0.25Vmol:
×0.25Vmol,溶液中c(Cl﹣):c(SO42﹣)=n(Cl﹣):n(SO42﹣)=0.25Vmol: ![]() ×0.25Vmol=2:3.
×0.25Vmol=2:3.
故选:B.
设氢氧化钠物质的量浓度为1mol/L,首先发生反应Mg2++2OH﹣═Mg(OH)2↓、Al3++3OH﹣═Al(OH)3↓,然后发生反应Al(OH)3+OH﹣═AlO2﹣+2H2O,由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为0.25V,物质的量为0.25Vmol,则n(Al3+)=0.25Vmol,根据离子方程式Al3++3OH﹣═Al(OH)3↓可知,沉淀Al3+消耗的氢氧化钠溶液的物质的量为0.25Vmol×3=0.75Vmol,沉淀Mg2+、Al3+总共消耗氢氧化钠溶液V,计算沉淀Mg2+消耗的氢氧化钠溶液的物质的量为Vmol﹣0.75molV=0.25Vmol,确定溶液中n(Mg2+)和n(Al3+),据此计算n(Cl﹣)与n(SO42)进行解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列事实,不能用平衡移动原理解释的是( )
A.硫酸工业中,增大O2的浓度有利于提高SO2的转化率
B.将FeS固体投入到含有Cu2+的废水中以除去Cu2+
C.选择合适的催化剂可使水在较低温度下分解
D.滴有酚酞的CH3COONa溶液,加热后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.请通过计算回答下列问题. 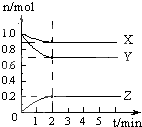
(1)反应开始至2min,Y的平均反应速率为;
(2)分析有关数据,写出X、Y、Z的反应方程式:;
(3)反应达到最大限度时,Y的转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HCOONa加热分解时,固体失重率与温度的关系如图所示,发生的反应有:
2HCOONa ![]() Na2C2O4+H2↑ ①
Na2C2O4+H2↑ ①
2HCOONa ![]() Na2CO3+H2↑+CO↑②
Na2CO3+H2↑+CO↑②
Na2C2O4 ![]() Na2CO3+CO↑ ③
Na2CO3+CO↑ ③
下列说法正确的是( )
A.T<415℃,只有反应①发生
B.反应①、②不可能同时发生
C.570℃<T<600℃时,残留固体的主要成分是Na2CO3
D.残留固体中的m(Na2C2O4)=m(Na2CO3)时,反应①、②的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是
卤素原子 | F | Cl | Br | I |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
A. FB. ClC. BrD. I
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁均为中学化学常见的物质,它们之间的转化关系如图(反应条件及其它产物已略去).下列说法不正确的是( ) 
A.若甲是AlCl3溶液,则丁可能是NaOH溶液
B.若甲是Fe,则丁可能是Cl2
C.若丁是CO2 , 则甲可能为Mg
D.若丁是O2 , 则乙、丙的相对分子质量可能相差16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列三种有机物是某些药物中的有效成分. 
下列说法正确的是( )
A.三种有机物都能发生水解反应
B.三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
C.将等物质的量的三种物质加入氢氧化钠溶液中,对羟基桂皮酸消耗氢氧化钠最多
D.使用FeCl3溶液和稀硫酸可以鉴别这三种有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n . 已知,最简单的氢铝化合物的分子式为Al2H6 , 它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法肯定错误的是( ) 
A.Al2H6在固态时所形成的晶体是分子晶体
B.氢铝化合物可能成为未来的储氢材料和火箭燃料
C.Al2H6中含有离子键和极性共价键
D.Al2H6在空气中完全燃烧,产物为氧化铝和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是周期表中的一部分,根据A﹣I在周期表中的位置,第(1)~(3)小题用元素符号或化学式回答,(4)~(6)小题按题目要求回答.
族 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)写出金属性最强元素与水的方应的方程式:
(2)A分别与D、E、G、形成的化合物中,稳定性由弱到强的顺序: ,
(3)F、H元素对应的最高价氧化物含氧酸由强到弱的顺序是: ,
(4)A和E组成化合物比A和F组成化合物的沸点(填“高”或“低”),原因是
(5)用电子式表示B的最高价氧化物对应的水化物的形成过程
(6)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com